Reacciones Catalizadas y Mtodos Catalticos de Anlisis - PowerPoint PPT Presentation
1 / 40
Title:
Reacciones Catalizadas y Mtodos Catalticos de Anlisis
Description:
Naturaleza y clasificaci n de las reacciones catal ticas ... Naturaleza y Clasificaci n de las Reacciones Catal ticas. Reacciones de Landolt ... – PowerPoint PPT presentation
Number of Views:411
Avg rating:3.0/5.0
Title: Reacciones Catalizadas y Mtodos Catalticos de Anlisis
1
Reacciones Catalizadas y Métodos Catalíticos de
Análisis
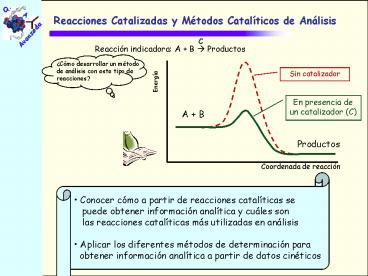
Cómo desarrollar un método de análisis con este
tipo de reacciones?
- Conocer cómo a partir de reacciones catalíticas
se - puede obtener información analítica y cuáles
son - las reacciones catalíticas más utilizadas en
análisis - Aplicar los diferentes métodos de determinación
para - obtener información analítica a partir de datos
cinéticos
2
Reacciones Catalizadas y Métodos Catalíticos de
Análisis
- Ecuaciones cinéticas y mecanismos de reacción
- Naturaleza y clasificación de las reacciones
catalíticas
- Tratamiento de datos experimentales en métodos
catalíticos métodos de determinación.
- Aplicación analítica de los efectos modificadores
de - la velocidad de las reacciones catalíticas
3
Reacciones Catalizadas y Métodos Catalíticos de
Análisis
- Ecuaciones cinéticas y mecanismos de reacción
- Naturaleza y clasificación de las reacciones
catalíticas
- Tratamiento de datos experimentales en métodos
catalíticos métodos de determinación.
- Aplicación analítica de los efectos modificadores
de - la velocidad de las reacciones catalíticas
4
Ecuaciones Cinéticas y Mecanismos de Reacción
Modelo cinético general
k1
C Catalizador B Reactivo en exceso A Sustancia
indicadora P,Y Productos estables
k-1
k2
La velocidad del proceso global depende de los
valores relativos de k1, k-1 y k2
5
Ecuaciones Cinéticas y Mecanismo de Reacción
(2) Es la etapa determinante de velocidad
1. k2 ltlt k-1
Situación de pre-equilibrio
Por tanto
Sustituyendo en la ecuación de velocidad
6
Ecuaciones Cinéticas y Mecanismo de Reacción
Situación de estado estacionario
2. k2 gtgt k-1 y k2 gtgt k1
sustituyendo
C C0 - CB
B B0 - CB
7
Ecuaciones Cinéticas y Mecanismo de Reacción
(1) Es la etapa determinante de velocidad
Situación de estado estacionario
2. k2 gtgt k-1 y k2 gtgt k1
Sustituyendo
C0 B0 B0
8
Ecuaciones Cinéticas y Mecanismo de Reacción
General
K Parámetro que depende de k1, k-1 y k2
?c Depende de las concentraciones de
especies distintas de C, A o P
Además
Por tanto
Ecuación fundamento del Análisis Cinético
Catalítico
9
Ecuaciones Cinéticas y Mecanismo de Reacción
Método de la Velocidad Inicial
Si se hacen medidas de velocidad inicial
Siendo ky k constantes a determinar por
calibración
Ecuación válida, siempre que
A0 gtgt C0
B0 gtgt C0
B0 gtgt A0
t 0
10
Reacciones Catalizadas y Métodos Catalíticos de
Análisis
- Ecuaciones cinéticas y mecanismos de reacción
- Naturaleza y clasificación de las reacciones
catalíticas
- Tratamiento de datos experimentales en métodos
catalíticos métodos de determinación.
- Aplicación analítica de los efectos modificadores
de - la velocidad de las reacciones catalíticas
11
Naturaleza y Clasificación de las Reacciones
Catalíticas
Oscilantes
De Landolt
Reacciones Catalíticas No Enzimáticas
Ordinarias
Reacciones Redox. Reacciones de
intercambio de ligandos. Reacciones de
descomposición, hidrólisis
quimioluminiscencia y otras.
12
Naturaleza y Clasificación de las Reacciones
Catalíticas
Reacciones Redox (más comunes)
Oxidantes
Reductores
H2O2 O2(aire) BrO3-, ClO3-, IO3- IO4- S2O82- Fe
(III) Ce (IV) Ag (I)
Sn (II) Fe (II) As (III) I- S2O32-,
SO32- Aminas Fenoles Colorantes azoicos Ácido
ascórbico
Catalizadores
Valencia 2/3 Valencia 4 Valencia 5 Valencia
6 Mo, W
Familia del
Platino Aniones
Fe3, Mn2, Cu2, Co2, Ni2
Zr, Hf, Th
V, Nb, Ta
Pt, Os, Pd Ru, Rh, Ir, Ag
I-, NO2-, Br-, S2- Se(IV), PO43-, Oxalato silicato
13
Naturaleza y Clasificación de las Reacciones
Catalíticas
Reacciones REDOX
Clasificación según los reaccionantes
Intercambian electrones s y p
Intercambian electrones d
Cu2, Ag, Mn3, Fe3
VO2, MoO42-, MnO4- Cr2, Ti3,
Fe2 V3, VO
H2O2, NO3-, ClO3-
S2O82-, I2 Cl-, Br-,
I-, HS- Sn2, fenoles, C2O42-
Oxidantes
Oxidantes
Reductores
Reductores
Más lentas
14
Reacciones Catalíticas Ordinarias (Redox)
A. Cambia el estado de oxidación del catalizador
Más sensibles
C(n1) Red Ox
? P Z
Reacción indicadora
Red C(n1) P Cn Cn
Ox C(n1) Z
Mecanismo
Fenoles, arilaminas Colorantes org.
Condiciones 1. Ox Red ?
Productos Cinéticamente impedida 2. Eox gt Ec
gt Ered
15
Reacciones Catalíticas Ordinarias (Redox)
A. Cambia el estado de oxidación del catalizador
Ejemplos
Suelen transcurrir a través de complejos de
transferencia de carga reductor-catalizador. -NH2,
NH, -OH
V(V) p-fenitidina BrO3- ?
Productos 20pg/ml
Ce4 As3 ? Ce3 As (V) I-
Ce4 ? Ce3 I? I? As3 ?
(I-As)3 (I-As)3 Ce4 ? Ce3 As (V)
I-
Reacción de Kolthoff-Sandell
16
Reacciones Catalíticas Ordinarias (Redox)
B. SIN Cambio del estado de oxidación del
catalizador
Oxidación por H2O2 en medio ácido
Catalizadores Fe (III), Ti (IV), Th (IV), V (V),
Nb (V) Cr (VI), Mo (VI), W (VI) Ta (V)
VERDADEROS OXIDANTES del PROCESO!!
Forman peroxocompuestos que se descomponen en
OH-, OH, O2H
Ejemplos
17
Naturaleza y Clasificación de las Reacciones
Catalíticas
Oscilantes
De Landolt
Reacciones Catalíticas No Enzimáticas
Ordinarias
- Reacciones Redox.
- Reacciones de intercambio de ligandos.
- Reacciones de descomposición,
- hidrólisis, quimioluminiscencia y otras.
18
Reacciones Ordiniarias (Quimioluminiscentes)
Catalizada por Co(II), Cu(II), Fe(III) Cr(III)
Mn(II) Ni(II)
19
Naturaleza y Clasificación de las Reacciones
Catalíticas
Oscilantes
De Landolt
Reacciones Catalíticas No Enzimáticas
Ordinarias
- Reacciones Redox.
- Reacciones de intercambio de ligandos.
- Reacciones de descomposición,
- hidrólisis, quimioluminiscencia y otras.
Catalizadores sin orbitales d vacíos, implican
la polarización del enlace, formación de
quelatos.
20
Reacciones Ordinarias (de Intercambio de Ligandos)
A. Intercambio de ligandos monodentados
C Hg2, Ag, Au (III)
B. Intercambio de ligandos polidentados
Entre dos metales
21
Naturaleza y Clasificación de las Reacciones
Catalíticas
Oscilantes
De Landolt
Reacciones Catalíticas No Enzimáticas
Ordinarias
- Reacciones Redox.
- Reacciones de intercambio de ligandos.
- Reacciones de descomposición, hidrólisis
- quimioluminiscencia y otras.
22
Reacciones de Landolt
Caracterizadas por que transcurre un tiempo desde
la mezcla de reaccionantes hasta que aparece el
producto medido Periodo de inducción, ti
Esquema general
k2 gt k1
El producto P sólo se detectará cuando L
(reactivo de Landolt) se haya consumido.
23
Reacciones de Landolt
C
A B P
Reacción catalizada
Reacción de Landolt
Empíricamente
C0 k ( 1 / ti)
Reacción No catalizada
ti
24
Reacciones Catalizadas y Métodos Catalíticos de
Análisis
- Ecuaciones cinéticas y mecanismos de reacción
- Naturaleza y clasificación de las reacciones
catalíticas
- Tratamiento de datos experimentales en métodos
catalíticos métodos de determinación.
- Aplicación analítica de los efectos modificadores
de - la velocidad de las reacciones catalíticas
25
Métodos de Determinación
ADQUISICIÓN DE LA CURVA CINÉTICA
Productos
Tratamiento matemático o Gráfico MÉTODOS DE
DETERMINACIÓN
Propiedad medida
Reactivos
Información analítica
tiempo
26
Métodos de Determinación
De curvas cinéticas
De periodo de inducción
Métodos de Determinación
Diferenciales
Integrales
Velocidad Inicial Tiempo fijo Tiempo variable
Tangente Tiempo fijo Tiempo variable
27
Métodos de Determinación
- Reacción de pseudo- primer orden
- respecto de la especie monitorizada
- o del reactivo que la origina.
Reacción Indicadora
A B P
C
(1)
(2)
(1) si se monitoriza el reactivo (2) si se sigue
el producto k constante cinética reacción
catalizada k constante cinética reacción
no-catalizada
28
Métodos de Determinación- Métodos Diferenciales
1. Métodos diferenciales
Se basan en medidas realizadas al comienzo del
proceso (cuando los cambios en las
concentraciones iniciales de reactivos son
despreciables)?A0 -P ? A0
1.1. Método de la velocidad inicial
Se mide la velocidad inicial ? t0
29
Métodos de Determinación- Métodos Diferenciales
1.1. Método de la velocidad inicial
v0
k1
t
C0
- Ventajas
- Las velocidades iniciales son altas
- t? 0 menor efecto de las reacciones laterales
- Aplicable a reacciones lentas
- Inconveniente
- Exige adquirir la curva cinética
30
Métodos de Determinación- Métodos Diferenciales
1.2. Método de tiempo fijo
Medida de ??P? a un ?t fijo
??P?
C01
C02
C03
C04
C0
?t
- Válido para reacciones reversibles
- Reacciones de pseudo-primer orden
- Reacciones enzimáticas
31
Métodos de Determinación- Métodos Diferenciales
1.3. Método de tiempo variable
Medida de ?t para un ?P constante
C01
???t
C02
C03
C04
C0
?t4
?t3
?t1
?t2
32
Métodos de Determinación- Métodos Integrales
Se emplean cuando no se puede despreciar P
frente a A0 en la ecuación de velocidad
Integrando
Si t1 0
33
Métodos de Determinación- Métodos Integrales
2.1. Método de la tangente
-tg ?
tg ?1
C01
C02
C03
C01
C03
C02
C0
34
Métodos de Determinación- Métodos Integrales
2.2. Método de tiempo fijo
Si ?t t2 - t1 cte.
Monitorizando A
Monitorizando P
( si t1 0)
35
Métodos de Determinación- Métodos Integrales
2.3. Método de tiempo variable o de concentración
constante
1 k C0 k ?t ln
k2 C0 k2
A1
A2
Donde
y
Método poco utilizado
36
Reacciones Catalizadas y Métodos Catalíticos de
Análisis
- Ecuaciones cinéticas y mecanismos de reacción
- Naturaleza y clasificación de las reacciones
catalíticas
- Tratamiento de datos experimentales en métodos
catalíticos métodos de determinación.
- Aplicación analítica de los efectos modificadores
de - la velocidad de las reacciones catalíticas
37
Activación e Inhibición de Reacciones Catalíticas
Sustancias que pueden modificar la velocidad de
reacciones catalizadas
Inhibidores vc lt vc
Activadores vc gt vc
v0 velocidad de la reacción en ausencia
de catalizador
Activación
vc velocidad de la reacción en presencia
de catalizador, C
vc
Inhibición parcial
vc velocidad de la reacción en presencia
de catalizador, C y distintas
concentraciones de modificador
v0
Inhibición total
38
Aplicaciones Analíticas de los Efectos
Modificadores
10-7 - 10-9 M 10-10 - 10-12 M
Métodos catalíticos
Análisis de trazas
Mejora de la sensibilidad
Usos analíticos de efectos modificadores de la
velocidad de una reacción catalizada
Activación
Inhibición
- Determinación del
- catalizador
- Determinación del
- activador
- Determinación del
- inhibidor
39
Aplicaciones Analíticas de los efectos
Modificadores
Activación
Determinación del activador
Determinación de ligandos complejantes del
catalizador
Determinación del catalizador
- Mejora la sensibilidad y rebaja los
- límites de detección
- Mejora la selectividad de la determinación
Ejemplo Reacción Ácido sulfanílico con el
peroxidisulfato (catalizador Ag(I)) Activador
2,2 dipiridilo mejora la sensibilidad en la
detección 5000 veces
40
Reacciones Catalizadas y Métodos Catalíticos de
Análisis
Dónde consultar para saber más del tema?
M. Valcárcel Cases y M.D. Pérez Bendito, Ed.
Métodos cinéticos de análisis. Publicaciones del
Monte de Piedad y Caja de Ahorros de Córdoba y
Universidad de Córdoba. Córdoba 1984.
D. Pérez Bendito, M. Silva. Kinetic Methods in
Analytical Chemistry. John Wiley Sons.
Chichester. 1988.
Horacio H. Mottola. Kinetic Aspects of Analytical
Chemistry. John Wiley Sons . New York. 1988.
M. Kopanica, V. Stara. Kinetic Methods in
Chemical Analysis. Wilson Wilsons
Comprehensive Analytical Chemistry. Vol.
XVIII Elsevier. Amsterdam. 1983.