Le nucl - PowerPoint PPT Presentation
Title: Le nucl
1
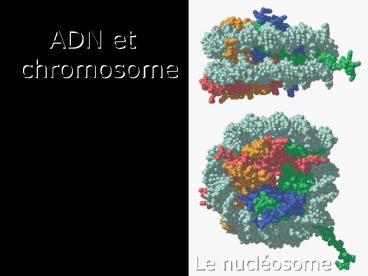
Le nucléosome
- ADN et chromosome
2
Solomon,D 2004, Nat cell Biol Heterochromatic
domains in a mouse nucleus
- Dimethylated Lys 9 of Histone H3 is shown in
green, the Swi/Snf core ATPase Brg1 in red, and
DNA in blue. The image was obtained using a Nikon
Microphot FX fluorescence microscope. Scale bar
represnts 3 µm. - The winner would like to acknowledge the support
of his advisor, Erik Knudsen, and technical
assistance from Nancy Kleene (both at the
University of Cincinnati College of Medicine,
USA).
Domaines hétérochromatiques dans un noyau de
souris
3
Plan
- I - Structure et fonction de l'ADN
- II - ADN chromosomique et emballage dans la fibre
chromatinienne - organisation des gènes le long de la molécule
d'ADN - III - Structure globale des chromosomes
- emballage de la molécule d'ADN dans les
chromosomes
4
III - Structure globale des chromosomes
- Chromosomes en écouvillon
- Chromosomes polytènes de la drosophile
- Hétérochromatine / Euchromatine
- a État de la chromatine ? expression des gènes
- b Télomères
- c Centromères
- d - Défense contre les éléments mobiles d'ADN
- Chromosomes mitotiques
- Organisation des chromosomes dans le noyau
interphasique
5
Structure globale des chromosomes (Rappel)
- I - ADN
- II - Nucléosomes ? 30nm (0,1 cm de long)
- III - 30nm ? organisation supérieure même en
interphase - Mal compris boucles, enroulements
6
1 - Chromosomes en écouvillon
- Dans une cellule en interphase, on ne voit pas
les chromosomes (trop petits et trop emmêlés) - MAIS il y a quelques exceptions où on voit
l'organisation supérieure des chromomes - ET on pense que certaines caractéristiques sont
représentatives pour tous les chromosomes - Un exemple les chromosomes appariés de
l'ovocyte d'amphibien - très actifs en transcription
- forment des boucles de chromatine rigides et
déroulées - ? le nom de chromosome en écouvillon
- visibles en microscopie optique
7
Fig 4-36(A)
- Chromosome en écouvillon (4 molécules d'ADN par
chromosome) Microscopie optique
0,1 mm
8
Fig 4-36(B)
- Microscopie optique à fluorescence AC contre les
protéines de maturation de l'ARN - La plupart des gènes portés par la boucle d'ADN
est en cours d'expression
9
Fig 4-37
- Structure du chromosome en écouvillon
- Environ 10 000 boucles au total
- La plupart de l'ADN est condensé en chromomère
- Chaque boucle correspond à une séquence d'ADN
spécifique - 4 copies de chaque boucle (diplotène)
10
Chromosomes en écouvillon illustration du
phénomène suivant
- La chromatine dont l'ADN est utilisé est
décondensée - La chromatine dont l'ADN n'est pas utilisé est
condensée
11
Applications du modèle chromosomes en écouvillon
- Dans les chromosomes en écouvillons
correspondance précise - Mais rarement observé dans les autres espèces
12
Applications du modèle chromosomes en écouvillon
- De l'ADN de poisson (sans chromosomes en
écouvillons) prend la forme de chromosomes en
écouvillon quand on l'injecte dans l'ovocyte
d'amphibien ? hypothèse - Les chromosomes en interphase de tous les
eucaryotes sont organisés en boucles trop petites
et trop fragiles pour être observables
13
Applications du modèle chromosomes en écouvillon
- Modèle d'étude pour l'ADN de mammifère qu'on
injecte dans un ovocyte d'amphibien - Corrélation
- boucle
- gène
- séquence d'ADN
14
2 - Chromosomes polytènes de la drosophile
- Autre exemple de chromosome interphasique visible
au microscope optique - Plusieurs milliers de molécules d'ADN par
chromosome chromosome polytène - chromosome polytène 1 chromosome avec beaucoup
de molécules d'ADN - Cellule polyploïde plusieurs lots de
chromosomes avec chacun une molécule d'ADN
15
Chromosomes polytènes de la drosophile
- Très étudié dans les cellules des glandes
salivaires de larve de drosophiles - 10 réplications sans séparation des 4 chromosomes
? 210 ( 1024) molécules d'ADN par chromosome
16
Fig 4-38
- Lot complet de chromosomes polytènes dans une
cellule de glande salivaire de drosophile - 4 paires de chromosomes différents (2n 8)
- Chaque paire est appariée ? chaque paire apparaît
comme une seule structure
17
Fig 4-39
- Microscopie optique d'une portion de chromosome
polytène - Alternance debandes sombres (95 de l'ADN) et
d'interbandes claires (5 de l'ADN) - Une bande ou interbande 1024 séquences d'ADN
alignées en phase - Une bande 3 000 à 300 000 paires de nucléotides
- Chaque bande est reconnaissable et numérotée
- Environ 5 000 bandes et 5 000 interbandes
18
Fig 4-40
- Microscopie électronique de chromosome polytène
- Chromatine plus condensée
- ou contient plus de protéines
- ou les deux
Chromatine moins condensée
19
Signification des bandes et des interbandes
- Toujours pas de réponse claire depuis 1930
- On a pensé que (faux)
- nombre de bandes ? nombre de gènes ?
- une bande ? un gène
- En fait c'est faux et
- Nombre de gènes ? 3 X nombre de bandes
- On trouve des gènes dans des bandes et
interbandes - Certaines bandes ont plusieurs gènes
- Certaines bandes n'ont pas de gènes
20
Signification des bandes et des interbandes
actuellement
- Bande / Interbande est le reflet de différents
niveaux d'expression génique - Interbandes
- chromatine moins compacte
- gènes plus exprimés
- Bandes
- chromatine plus compacte
- gènes moins exprimés
- Le chromosome polytène est le reflet de la nature
hétérogène de la compaction de la chromatine de
tous les chromosomes interphasiques
21
Ecdysone
- Hormone stéroïde qui contrôle l'expression des
gènes des chromosomes polytènes de la drosophile - Taux montent et descendent en fonction du
dévelopement larvaire - si le taux monte les gènes codant pour les
protéines s'expriment
22
Boursouflures chromosomiques ( "puffs" nodules)
- Au fur et à mesure du dévelopement des
boursouflures chromosomiques apparaissent puis
disparaissent quand de nouveaux gènes s'expriment
ou s'éteignent - Un puff ? décondensation d'une bande
23
Fig 4-41
- Renflements chromosomiques (bras gauche du
chromosome 3) apparition et disparition des
renflements chromosomiques le long du chromosome
polytène - Chacun des 5 "puff" n'est actif que pendant une
courte période
22 heures
24
Anneaux de Balbiani
- "Puff" particulièrement grand d'un chromosome
polytène - Arrangement de la chromatine en boucles (comme
dans les chromosomes en écouvillon) - Visibles en microscopie électronique
- Surtout (que) dans les cellules des glandes
salivaires du moucheron Chironomus tentans - Chaque boucle contient un gène unique
25
Fig 4-42(A)
- Synthèse d'ARN dans un "puff" chromosomique
(Chironomus tentans) AC anti BrU
Nouvel ARN à partir d'un anneau de Balbiani
ARN synthétisés avant l'addition du BrUTP ayant
diffusé de l'anneau de Balbiani
ARN synthétisés à partir d'un l'anneau de
Balbiani avant l'addition du BrUTP
26
Fig 4-42(B)
Un "puff" d'un chromosome polytène
27
Fig 4-43(gauche)
- Chromosome polytène de Chironomus tentans
- Coupe dans un anneau de Balbiani (l'ensemble est
un "puff")
28
Daneholt,B2001p7012
- Salivary gland cells in the larvae of the
dipteran Chironomus tentans offer unique
possibilities to visualize the assembly and
nucleocytoplasmic transport of a specific
transcription product. Each nucleus harbors four
giant polytene chromosomes, whose transcription
sites are expanded, or puffed. On chromosome IV,
there are two puffs of exceptional size, Balbiani
ring (BR) 1 and BR 2. A BR gene is 3540 kb,
contains four short introns, and encodes a 1-MDa
salivary polypeptide. The BR transcript is packed
with proteins into a ribonucleoprotein (RNP)
fibril that is folded into a compact ring-like
structure. The completed RNP particle is released
into the nucleoplasm and transported to the
nuclear pore, where the RNP fibril is gradually
unfolded and passes through the pore. On the
cytoplasmic side, the exiting extended RNP fibril
becomes engaged in protein synthesis and the
ensuing polysome is anchored to the endoplasmic
reticulum. Several of the BR particle proteins
have been characterized, and their fate during
the assembly and transport of the BR particle has
been elucidated. The proteins studied are all
added cotranscriptionally to the pre-mRNA
molecule. The various proteins behave differently
during RNA transport, and the flow pattern of
each protein is related to the particular
function of the protein. Because the
cotranscriptional assembly of the pre-mRNP
particle involves proteins functioning in the
nucleus as well as proteins functioning in the
cytoplasm, it is concluded that the fate of the
mRNA molecule is determined to a considerable
extent already at the gene level.
29
Daneholt,B2001p7012(fig1)
- Electron micrograph showing chromosome IV with
its three giant puffs (Balbiani Rings) in a
salivary gland cell from C. tentans. The three
BRs (BR1, BR2, and BR3) are indicated as well as
the nucleoplasm (Npl) and cytoplasm (Cpl). The
arrows mark a few prominent transcription loops
(cf. Fig. 2D). (Bar equals 2 µm.)
Electron micrograph showing chromosome IV with
its three giant puffs (Balbiani Rings) in a
salivary gland cell from C. tentans. The three
BRs (BR1, BR2, and BR3) are indicated as well as
the nucleoplasm (Npl) and cytoplasm (Cpl).
30
Daneholt,B2001p7012(fig2)
- Intracellular distribution of the cap-binding
protein CBP20 in C. tentans salivary gland cells
studied by immunoelectron microscopy. The
assembly of the BR RNP particle is shown in AD
proximal portions of the BR gene are displayed in
A, distal portions in B and C, and a schematic
drawing of the BR gene in D (p, proximal m,
middle d, distal portions of the gene). The fate
of the released BR particles is shown in EH BR
particles are present in the nucleoplasm (E), at
the pore (F), and in an unfolded conformation
when passing through the pore (G and H). Gold
particles are marked by arrows and indicate the
position of CBP20. It should be noted that gold
particles are at the leading 5' end of the BR
particle when it passes through the nuclear
pore.(Bar equals 100 nm.)
31
Daneholt,B2001p7012(fig3)
- Assembly and transport of the BR RNP particle and
its relation to a number of BR RNA-associated
proteins. The BR particle is assembled on the
gene (left), passes through the nucleoplasm,
unfolds, and translocates through the nuclear
pore (middle). On the cytoplasmic side, the BR
RNP fibril becomes engaged in protein synthesis
and the polysomes anchor at the endoplasmic
reticulum (right). The tripartite nuclear pore
complex with its central channel is seen in black
and its nuclear and cytoplasmic fibers are
presented in pink. The BR gene with its five
exons is displayed above the BR particle scheme,
and the flow patterns of the BR RNA-associated
proteins are outlined below. snRNP, small nuclear
RNP.
1, 2, 3, 4, 5 exons
BR RNA-associated proteins
32
Fig 4-42(droite)
- Boucle de chromatine dans un anneau de Balbiani
33
Conclusions sur les anneaux de Balbiani
- Quand le gène s'exprime, la fibre de chromatine
de 30 nm se décondense mais garde ses 4 histones - Par défaut la fibre est sous la forme 30 nm
- Peuvent décondenser cette fibre
- les modifications des histones
- les complexes de remodelage de la chromatine
- les protéines de régulation de l'expression des
gènes - La boucle serait un domaine fonctionnel
indépendant
34
Extrapolation
- Tout l'ADN des chromosomes polythènes est
organisé en boucles qui se condensent et se
décondensent - Tous les chromosomes interphasiques de tous les
eucaryotes sont emballés en boucles contenant
quelques gènes dont l'expression est régulée de
façon coordonnée
35
Fig 4-44
- Modèle de structure du chromosome interphasique
- Déduit à partir de quelques cas rares
20 000 à 100 000 paires de nucléotides
36
3 - Hétérochromatine / Euchromatine
- État de la chromatine ? expression des gènes
- Télomères
- Centromères
- Défense contre les éléments mobiles d'ADN
37
Historique (1938)
- Deux types de chromatine en interphase (MO)
- Hétérochromatine toujours condensée (même en
interphase) - Euchromatine le reste
38
Actuellement
- Euchromatine (? fibre de 30 nm et boucles)
- Hétérochromatine
- contient des protéines supplémentaires
- Plus compacte
- ? 10 du génome est hétérochromatique
- Régions spécifiques centromères et télomères
39
Hétérochromatine
- Son ADN ne contient presque pas de gènes
- Les gènes emballés dans de lhétérochromatine ne
peuvent pas sexprimer - Fonctionnement des télomères et centromères
- Certains gènes ont même besoin dêtre localisés
dans de lhétérochromatine pour sexprimer - Le mot hétérochromatine comprend plusieurs types
de structure de chromatine avec un très haut
degré dorganisation - Lhétérochromatine nest pas un emballage dADN
"mort"
40
a - Expression de l'hétérochromatine
- Un gène qui s'exprime dans de l'euchromatine ne
s'exprime plus s'il est localisé dans de
lhétérochromatine il devient "silencieux" ?
exemple d'effet de position - Effet de position l'activité d'un gène dépend
de sa position le long du chromosome
41
Effet de position
- Découvert chez la drosophile
- influence de l'état de la chromatine le long du
chromosome sur l'expression du gène ? - Chromosome mosaïque de formes différentes de
chromatine dont chacune a un effet particulier
sur la capacité de l'ADN à être sous le contrôle
de la cellule
42
Deux exemples de diversification par effet de
position
- 1 - Gène ADE2 de la levure
- 2 - Gène white de la drosophile
43
Exemples de diversification par effet de position
1/2 Gène ADE2 de la levure
- Gène ADE2 de la levure
- Position normale ? expression
- Position près du télomère (hétérochromatique) ?
pas d'expression - ADE2 code pour une enzyme de la synthèse de
l'adénine - Si absence ? accumulation de pigment rouge
- Parfois le gène redevient actif dans la
descendance emballage moins serré de
l'hétérochromatine
44
Fig 4-45 (A)
- Exemples de diversification par effet de position
Gène ADE2 de la levure
45
Exemples de diversification par effet de position
2/2 Gène white de la drosophile
- Le gène white contrôle la couleur des yeux
- Gène white normal (allèle sauvage white ? yeux
rouges) - Gène white muté (allèle muté white - ? yeux
blancs d'où le nom) - Le gène white normal (white )
- Position normale ? expression ? yeux rouges
- Position proche de hétérochromatine ? pas
d'expression ? yeux blancs - En fait mottes rouges et blanches présence de
rouge car pas d'inactivation pendant la période
embryonnaire
46
Fig 4-45 (B)
- Exemples de diversification par effet de position
Gène white de la drosophile
47
Deux exemples de diversification par effet de
position gène ADE2 de la levure et gène white
de la drosophile
- Un gène peut se réactiver (colonies rouges et
blanches, yeux avec mottes rouges et blanches) - Une fois réactivé, transmission aux cellules
filles - Si emballé avec l'hétérochromatine, inactivation
transmises aux cellules filles
48
Deux caractères de l'hétérochromatine
- Dynamique
- Peut s'étendre puis se retirer
- État héritable d'une cellule à la fille
- Explique la "diversification par effet de
position"
49
Fig 4-46(A)
- ADN limitant empêchant l'hétérochromatine de
déborder sur l'euchromatine (peut disparaître au
cours de remaniements)
50
Fig 4-46(B)
- Débordement variable de l'hétérochromatine au
cours du développement hérité précocément ?
aspect "bariolé" (variegated) de ces mouches
51
b Télomères
- Le meilleur modèle S. cerevisiae
- Pas d'expression de gène à 5000 paires de
nucléotides des extrémités des chromosomes
structure hétérochromatique - Intervention d'enroulement et de protéines
- Beaucoup de ces protéines sont connues chez S.
cerevisiae Silent information regulator
(protéines Sir)
52
Protéines Sir (Silent information regulator)
- Des mutations dans les protéines Sir empêchent le
silence des gènes proches des télomères - Découverte d'un complexe de protéine Sir lié au
télomère qui reconnaît les queues de certaines
histones sous-acétylées
53
Fig 4-47(A)
- Hétérochromatine de l'extrémité des chromosomes
de levure
H4
H4
54
Kimura,A2002p370 Nat Genet(fig5)
- Model of the role of acetylation of H4Lys16 in
the localization of silencing proteins along
chromosomes. a, Model of the region-dependent
regulation of the interaction between Sir3p and
H4 through the reversible acetylation of H4Lys16
by Sas2p and Sir2p. b, Model of the function of
the chromosomal gradient as a boundary to prevent
the spread of silencing proteins. In the wildtype
strain (top), the marked increase in the
acetylation of H4Lys16 from the end of the
telomere to the telomere-proximal region acts as
a steep slope that Sir3p (green spheres) must
overcome to diffuse throughout the chromosome. In
the absence of Sas2p (middle), acetylation of
H4Lys16 in the telomere-proximal region is
decreased, which allows Sir3p to diffuse. In the
absence of Sir2p (bottom), deacetylation of
H4Lys16 at the ends of the telomere does not
occur, and Sir3p is not retained in this region.
55
Suka,N2002p378(fig6) Nat Genet 32,(3)Sir2p and
Sas2p opposingly regulate acetylation of yeast
histone H4 lysine16 and spreading of
heterochromatin
56
Sir2 (Silent information regulator 2)
- Désacétylase d'histone ? sous acétylation
d'histone propre à l'hétérochromatine ? emballage
plus serré des nucléosomes - Très conservée
57
Fig 4-47(B)
- Protéines de liaison à l'ADN spécifiques ?
fixation d'une protéine Sir (Sir2?) le long du
chromosome ? désacétylation des queues d'histones
(par Sir2) ? création de nouveaux sites de
fixation de Sir
58
Fig 4-48(A)
- Modèle hypothétique d'héritabilité de
l'hétérochromatine
59
Fig 4-48(B)
- Modèle hypothétique d'héritabilité de
l'hétérochromatine
60
Rôle des histones méthyl transférases
- Méthylent des lysines spécifiques (K9 de H3)
- Lue par les composants hétérochromatiques ?
- Assemblage en hétérochromatine
61
Intérêt des télomères
- Protection des extrémités des chromosomes
- Régulation de la longueur des chromosomes
- Ségrégation des chromosomes pendant la mitose
62
Résumé
- Modifications covalentes des histones
- Transmises
63
c Centromères
- Séquences d'ADN qui permettent la ségrégation des
chromosomes - Présence dhétérochromatine autour des
centromères - Centromères inclus dans de grandes étendues
d'hétérochromatine où les gènes ne s'expriment
pas (si on en met)
64
Hétérochromatine centrique (centromérique)
- Histones
- Sous acétylées
- Méthylées
- Autres protéines
- Modèle d'étude S. cerevisiae
65
S. Cerevisiae
- 125 paires de nucléotides sont suffisants pour
former un centromère - Plus une douzaine de protéines ?
- Un nucléosome spécifique de centromère
66
Fig 4-49
- Nucléosome de centromère chez S. cerevisiae
Variant de histone H3 (CENP-A) H2A H2B
H4 plus d'autres protéines
67
Fig 4-49
- Chromosomes mitotiques de Drosophile
Histone H3 conventionnelle fusionnée avec GFP (?
couleur verte de H3) En rouge composant du
kinétochore coloré par un AC spécifique
68
Fig 4-49
- Chromosomes mitotiques de Drosophile
Histone H3 spécifique du centromère fusionnée
avec GFP (? couleur verte de H3) En rouge
composant du kinétochore coloré par un AC
spécifique Localisation des centromères en
jaune
69
Organismes complexes
- Drosophile, humain
- Centaines de milliers de paires de nucléotides
- Pas de séquence d'ADN spécifique
- ADN ? satellite (petites séquences d'ADN répétées)
70
Fig 4-50
- Structure d'un centromère humain
71
Séquences centromériques
- Les mêmes séquences d'ADN ? satellite placées sur
d'autres chromosomes ne forment pas de
centromères !!! - De plus formation du kinétochore ???
- Rôle des protéines gt rôle de l'ADN ???
- Formation et maintien de centromère ? Formation
et maintien de hétérochromatine
72
Aspect phylogénétique des centromères
- Présence d'ADN ? satellite non fonctionnel sur
des chromosomes identique à l'ADN ? satellite des
centromères ? - Phénomène de fusion de chromosomes avec création
d'un nouveau centromère qui devient inactif - Possibilité de formation de néocentromères sans
ADN ? satellite
73
Fig 4-51(AB)
- Phénomène de fusion de chromosomes avec création
d'un nouveau centromère qui est devenu inactif
- Chromosome surnuméraire qui se crée un centromère
sur de l'ADN non ? satellite
74
Fig 4-51(C)
- Modèle d'explication de la plasticité et de
l'héritabilité des centromères
75
Plasticité des centromères
- Formation de complexes de protéines de liaison à
l'ADN qui ont plus d'"appétit" pour l'ADN ?
satellite - Cette marque pourrait se "perdre" (!!!)
- Avantage évolutif
- Évolution des chromosomes par cassure-recollement
(cf. évolution)
76
d Défense contre les éléments mobiles d'ADN
- En résumé
- Hétérochromatine ? courtes séquences répétées
d'ADN en tandem (pas de codage de protéines) - Euchromatine ? riche en gènes à copie unique
- Mais
- Il y a des gènes dans l'hétérochromatine
- Il y a des séquences répétées dans l'euchromatine
77
Mutité génique induite par la répétition du gène
- Si on introduit des séquences répétées de gènes
dans le génome (souris ou drosophile) ? - Pas d'expression
- Formation d'hétérochromatine
- Si on introduit la séquence unique du même gène
au même endroit ? - Expression du gène
78
Mutité génique induite par la répétition du gène
- Mécanisme de protection contre l'invasion par les
éléments génétiques mobiles - Emballage en hétérochromatine et mutisation des
éléments pour éviter leur prolifération - Même mécanisme pour l'hétérochromatine juxta
centromérique ?
79
4 - Chromosomes mitotiques
- Stade ultime de condensation
- Seul moment où les chromosomes sont visibles
(exception écouvillon, polythènes) - Raccourcissement du chromosome interphasique de
10 fois
80
4 Chromosomes mitotiques
- a Caryotype
- b Emballage de la chromatine dans le chromosome
mitotique
81
a Caryotype
82
Fig 4-52
- Chromosome mitotique typique 2 chromatides
contenant chacune une molécule d'ADN identique
générée pendant la phase S du cycle cellulaire
83
Fig 4-53
- Extrémité d'un chromosome mitotique vue en
microscopie à balayage nombreux domaines en
boucle après extraction des complexes de
riboprotéines
84
Fig 4-54
- Microscopie électronique d'un chromosome
mitotique - Les boucles émanent d'une charpente centrale
- Boucle ? gène (très grossièrement)
85
Caryotype
- 46 chromosomes
- Marquage longitudinal
86
Caryotype bandes G
87
Caryotype bandes G
88
Caryotype spectral
89
Caryotype un chromosome
- Bras (p ou q)
- Région (eg p1)
- Bande (eg p11)
- Sous-bande (eg p11.2)
- Sous-sous-bande (eg p11.23)
90
Bandes
- S'observent chez toutes les espèces humain,
drosophile - Très conservées
- Homme ? chimpanzé, gorille, orang-outan
91
Fig 4-57
- Comparaison du plus grand chromosome humain (le
1) avec celui du chimpanzé,du gorille et de
l'orang-outan ? - Les chromosomes sont organisés en très grands
domaines importants pour leur fonction
92
Corrélationbande du chromosome métaphasique
?bande du chromosome polythène
- Aucune relation
- Du début de la mitose à la fin les bandes sont
- De moins en moins nombreuses (elles fusionnent)
- De plus en plus épaisses
93
Corrélationbande du chromosome métaphasique
?bande du chromosome polythène
- La bande la plus fine du caryotype contient plus
d'un million de paires de nucléotides ( un
génome bactérien) - Bandes plus ou moins riches en GC (ou AT)
- ? à peu près aux bandes des chromosomes
94
Zones GC riches
- Bandes R
- Forte densité en gène
- Gènes domestiques
- Empaquetage des boucles de chromatine
- Plus de molécules qui participent à l'expression
des gènes
95
Zones AT riches
- Bandes G
96
b Emballage de la chromatine dans le chromosome
mitotique
97
Fig 4-55
- Emballage de la chromatine
98
c - Condensation des chromosomes en mitose
- Deux conséquences
- Individualisation des chromatides
- Protection des chromosomes
- Nécessité des condensines
99
Condensines(incluent les SMC)
- Utilisent de l'ATP
- Servent à l'enroulement du chromosome
interphasique - Gros complexes protéiques qui contiennent les
protéines SMC (Structural Maintenance of
Chromosomes)
100
Protéines SMC(sont incluses dans les condensines)
- Composants d'un complexe de condensine beaucoup
plus gros - Longues molécules dimériques
- avec une charnière centrale
- Domaine globulaire à chaque extrémité
- ADN SMC ATP ? grandes boucles d'ADN ADP
- Composant important des chromosomes mitotiques
une molécule tous les 10 000 nucléotides
101
Fig 4-56
- Protéine SMC
102
5 - Organisation des chromosomes dans le noyau
interphasique
- Noyau différent d'un sac à chromosomes
- En interphase semble désordonné
- En mitose très orienté
- Centromère d'un côté
- Télomères de l'autre
- Dans certains noyaux persistance de cette
disposition en interphase orientation rabl
103
Fig 4-58
- Racine de plante en interphase en fluo
- Centromères en vert
- Télomères en rouge
104
Fig 4-59
Polymère en solution
Embryon de drosophile
105
Embryon de drosophile
- Division cellulaire toutes les 10 minutes
- Les chromosomes n'ont pas le temps de quitter
l'orientation rabl - Quand l'interphase est plus longue les
chromosomes ont le temps de se replier - Ce repliement est lié à des associations
spécifiques à l'intérieur de différentes régions
d'un même chromosome
106
Cellule "commune"
- Les centromères sont dispersés
- Chaque chromosome semble avoir une position
donnée et son petit territoire tous les
chromosomes ne sont pas emmêlés les uns dans les
autres
107
Fig 4-60
- Chromosome painting de deux chromosomes
interphasiques de lymphocytes humains
Les deux chromosomes 19
Les deux chromosomes 18
108
Croft,A1999p1119(fig1)
- Human chromosomes 18 and 19 interphase
territories. 2D preparations of nuclei, swollen
in hypotonic and fixed either with MAA (a-d) or
with 4 pFa (e), were hybridized with HSA18 and
19 paints. In the central panels of a-e HSA18 and
19 paints were biotinylated and detected with
avidin-FITC (green). In the left-hand panels of a
and b, paints were labeled either with biotin and
detected with TR (red) or with digoxigenin and
detected with FITC (green). All nuclei were
counterstained with DAPI (blue). (a) Primary
lymphocytes (b and e) lymphoblastoid cell line
(c) primary fibroblasts (d) HT1080 fibrosarcoma
cells. Bars, 2 µm. On the right, histograms show
the mean proportion of DAPI stain (blue bars),
and HSA18 (filled bars) and HSA19 (open bars)
hybridization signals in each of the five
concentric shells of equal area eroded from the
periphery (1) to the center (5) of 50 segmented
nuclei. Error bars show SEM.
109
Croft,A1999p1119(fig2)
- Fig. 2. Subnuclear localization of HSA18 and
19 in optical sections through 3D-preserved
nuclei. Confocal z series (1 µm) of hybridization
to 4 pFa-fixed 3D human dermal fibroblasts with
paints for either HSA18 (a and b) or HSA19 (c and
d), prepared from randomly amplified total DNA
from each chromosome and detected with FITC
(green-yellow) and counterstained with PI (red).
Cells were either untreated (a and c) or treated
with DRB (b and d). Bars, 10 µm.
110
Croft,A1999p1119(fig3)
- HSA18 and 19 territories through the cell cycle.
- (a) Combined FISH and immunofluorescence in 4
pFa-fixed 3D fibroblasts with either chromosome
18 or 19 paints (green) and with antibodies
against pKi-67 (red) and B-type lamin (blue). The
cells on the left are in early stages of G1 and
those on the right in mid G1, S, or G2 based on
their pattern of pKi-67 staining (Bridger et al.,
1998 ). Bar, 5 µm. - (b) FISH for HSA18 or 19 (red) in flattened
preparations of MAA-fixed lymphoblast nuclei,
pulsed with BrdU (green), and separated by
centrifugal elutriation. Blue is DAPI. Bar, 2 µm.
FACS analyses of PI-stained nuclei from
elutriated fractions chosen to represent G1,
early S, late S, and G2 are shown beneath each
panel. Horizontal bars on the FACS profiles
indicate the gating for cells in G1 (left) and
for those in S and G2 (right).
111
Croft,A1999p1119(fig4)
- Dependence of territory sizes on transcription
and histone deacetylation - (a) Frequency histograms of the proportion of
nuclear area occupied by hybridization signals
(detected with FITC) of HSA18 (filled bars) and
19 (open bars) in 50 swollen and flattened
MAA-fixed lymphoblastoid nuclei. - (b) Histograms of the proportion of summed
nuclear area occupied by hybridization signals
(detected with FITC) of HSA18 (filled bars) and
19 (open bars) through the confocal sections of
5-10 fibroblast nuclei fixed with 4 pFa.
Vertical solid and dashed lines show mean
proportionate areas for HSA18 and
19, respectively. Cells were either untreated, or
treated with AMD, DRB, or TSA before harvest.
DRB-treated cells were also grown for 1 h in the
absence of DRB (DRB release).
112
Croft,A1999p1119(fig5)
- Fig. 5. The orientation of chromosomes 18 and
19 in normal nuclei and those from a t(1819). (a
and b) Lymphoblast nuclei cohybridized with
paints specific for 18p and q arms (Guan et al.,
1996 ). 18p is in red in a and in green in b. 18q
is in the reciprocal color in each case, as
indicated. DAPI counterstain is blue. (c and d)
Lymphoblast nuclei cohybridized with paints
specific for 19p and q arms (Guan et al., 1996 ).
19p is in red in c and in green in d. 19q is in
the reciprocal color in each case, as indicated.
DAPI counterstain is blue. (e) Flattened primary
lymphocytes hybridized simultaneously with HSA18
paint (red) and telomeric clones 52M11 and 75F20
(green) specific for 18pter and qter,
respectively. DAPI counterstain is blue. (f)
3D-preserved nuclei cohybridized with HSA18 paint
(green) and telomeric clones 52M11 and 75F20
(red). Red signal in the cytoplasm is from
endogenous biotin. Telomere signals are apparent
with only one of the territories, those
associated with the other territory are in a
different focal plane. (g) FISH to a metaphase
spread from an individual with t(18 19)(p11p13)
with chromosome 18 material shown in green and
19 in red. The appropriately colored arrows
indicate the derived chromosomes. (h and i)
Interphase nuclei from t(1819) cells.
HSA18-derived material is detected in green in h
and in red in i. HSA19 is detected in the
reciprocal color in each panel as indicated. As
in g, appropriately colored arrows indicate the
derived chromosomes. A line was drawn from the
center to the edge of the nucleus passing through
each derived chromosome. A second line,
perpendicular to the first, was put through the
middle of the signal and it was ascertained which
side of this line the translocated portion was
found. (j) Histograms of the position of the edge
of the signal in relation to the edge or the
center of the nucleus, in 50 t(1819) nuclei, for
both the normal (open bars) and derived (filled
bars) chromosomes 18 and 19. There is no
significant difference in the positions of
derived and normal chromosomes (P lt 0.059 for
HSA18 and P lt 0.110 for HSA19).
113
Croft,A1999p1119(fig6)
- Associations of HSA18 and 19 with nuclear
substructure. Lymphoblastoid nuclei extracted
with 0.5, 1.0, 1.2, and 1.8 M NaCl, fixed with
MAA, and hybridized with alternately labeled
chromosome 18 and 19 paints, the color of which
is indicated at the right of each panel. DNA was
stained with DAPI (shown in blue on the right and
in black and white on the left). Chromosome
19 material is retained within the residual
nucleus. HSA18 is released into the DNA halo at
high salt concentrations. Bar, 2 µm.
114
Schémas hypothétiques d'organisation des
chromosomes dans le noyau
- Fixation du chromosome à l'enveloppe nucléaire
- Existence d'un "nucléosquelette"
115
1 - Fixation du chromosome à l'enveloppe nucléaire
- Par leurs télomère par exemple
- Toutefois position non fixe dans le noyau
116
Fig 4-61
- Noyaux d'embryons de drosophile localisations
de deux régions différentes (jaune et magenta) du
chromosome 2 proches de l'enveloppe nucléaire (AC
antilamina en vert)
117
2 - Existence d'un"nucléosquelette" (1de2)
- "Matrice" nucléaire
- "Charpente nucléaire" (ce qui reste après
extraction) - Certaines des protéines peuvent se lier à des
séquences spécifiques de l'ADN appelées SARs
(Scaffold Associated Regions)ou MARs (Matrix
Associated Regions)
118
2 - Existence d'un"nucléosquelette" (2de2)
- Formeraient la base des boucles
- Existence in vivo ?
- Organisation des chromosomes ? localisation des
gènes ? expression des gènes