Transizioni stato nativo-stato denaturato - PowerPoint PPT Presentation
1 / 34
Title:
Transizioni stato nativo-stato denaturato
Description:
Title: PowerPoint Presentation Last modified by: Mariano Created Date: 1/1/1601 12:00:00 AM Document presentation format: Presentazione su schermo – PowerPoint PPT presentation
Number of Views:90
Avg rating:3.0/5.0
Title: Transizioni stato nativo-stato denaturato
1
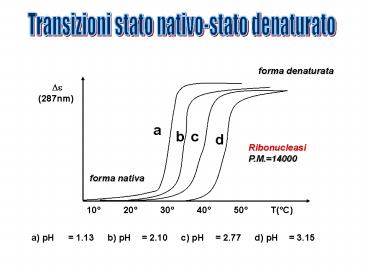
Transizioni stato nativo-stato denaturato
forma denaturata
?? (287nm)
a
b
c
d
Ribonucleasi P.M.14000
forma nativa
10 20 30 40 50 T(C)
a) pH 1.13 b) pH 2.10 c) pH 2.77 d) pH
3.15
2
N ? D
Denaturazione termica della Chimotripsina
(pH2.0)
3
Transizioni stato nativo-stato denaturato
N ? D
Denaturazione termica della Ribonucleasi A
(pH2.1)
4
(No Transcript)
5
A pH2.5, T303K, p1 atm
Predomina la forma nativa
A pH2.5, T313K, p1 atm
Predomina la forma denaturata
6
Parametri termodinamici per la denaturazione
termica della Ribonucleasi A (pH2.5)
7
G(D)
Tm
G(N)
?G G(D)-G(N)
Tm
20 40 60 80 T(C)
20 40 60 80 T(C)
8
Forma denaturata
Forma nativa
9
La variazione di capacità termica del processo di
denaturazione è data dalla differenza tra le
rette caratteristiche della forma nativa e
denaturata
Dallintegrazione della curva sperimentale si
ottengono la variazione entalpica ed entropica
del processo
10
- Le variazioni entalpiche ed entropiche con la
temperatura sono grandi e positive. Il contributo
entalpico è sfavorevole al processo di
denaturazione e lintero processo è quindi
guidato dal contributo entropico favorevole. - ?G0 è piccolo a causa di effetti di
compensazione tra effetti entalpici ed entropici.
Bastano piccole variazioni nei contributi
entalpici ed entropici per far variare il segno
complessivo dellenergia libera standard.
Laumento di pH sfavorisce il processo di
denaturazione (?G0 gt 0), il punto di flesso delle
curve di transizione (?G00, ?H0 Tm ?S0) si
sposta a temperature maggiori. - La capacità termica è relativamente elevata
(?Cp2kcalmol-1), come conseguenza della
elevata dipendenza dei termini entalpici ed
entropici dalla temperatura.
11
Landamento è in accordo con quanto previsto
dallequazione di Vant Hoff
Poiché ?H0gt0 la reazione di denaturazione è
favorita da un aumento di temperatura.
Analogamente, poiché
laumento di temperatura favorisce lo stato a
entropia maggiore (forma denaturata).
12
Influenza del pH
- Le proteine tendono ad essere più stabili intorno
al punto isoelettrico (carica nulla). - Il pH influenza gli equilibri di deprotonazione
dei residui polari (Lys, Gln, Asp) e determina la
carica totale sulla superficie proteica
(repulsione elettrostatica tra i gruppi
ionizzabili). - Determina inoltre la rottura dei ponti salini tra
gruppi ionizzati di diverso segno (Ex. Asp70 e
His31 nella lisozima). - Come risultato molte proteine denaturano in
maniera irreversibile a valori estremi di pH
(pHlt5 o pHgt10).
13
Denaturazione chimica
- La denaturazione di una proteina può essere anche
indotta mediante laggiunta di agenti chimici in
grande eccesso, come lurea o lo ione guanidinio. - formazione di legami idrogeno competitivi con i
gruppi peptidici - stabilizzazione dello stato denaturato
attraverso linterazione preferenziale con la
superficie proteica. Infatti lurea e lo ione
guanidinio aumentano la solubilità di tutti i
residui, sia polari che apolari, diminuendo di
circa il 30 lentità del contributo idrofobico,
con un conseguente aumento della superficie
esposta.
14
Ferritina umana
15
Linsieme di questi effetti è dovuto in larga
parte a fenomeni di solvatazione.
Glu Arg
Glu
Lys
Lys
Arg
Lys
Lys
Phe Ile Leu Val
Ile
Leu
Arg
Phe
Val
Arg
Forma nativa Forma denaturata
Formazione di clusters di acqua intorno ai
residui apolari
16
Allaumentare della temperatura cresce il peso
del contributo entropico favorevole, favorendo il
processo di denaturazione. Inoltre allaumentare
della temperatura le strutture ordinate di
solvente tendono a rompersi, rilasciando molecole
libere di muoversi liberamente in
soluzione. Questo comporta un ulteriore aumento
di entropia e anche una variazione entalpica
associata alla parziale distruzione dei legami
idrogeno che stabilizzavano le strutture a
clusters. Il risultato dellinsieme di questi
processi è una forte dipendenza dei contributi
entalpici ed entropici dalla temperatura.
17
Molten Globule
N ? MG ? D
Il Molten Globule rappresenta una struttura
intermedia tra la forma nativa e quella
denaturata. E caratterizzato da un contenuto di
struttura secondaria paragonabile a quello della
forma nativa, ma con un volume molare molto più
grande (50).
18
- Le caratteristiche principali di uno stato molten
globule sono - le dimensioni totali di questo stato sono minori
di quelle associate ad un gomitolo statistico e
sono solo lievemente maggiori di quelle dello
stato nativo - (ii) il contenuto di struttura secondaria è
confrontabile con quello dello stato nativo - (iii) le interazioni con il solvente (cioè la
superficie esposta al solvente) sono molto
maggiori di quelle dello stato nativo, ma molto
minori dello stato completamente denaturato - (iv) linterconversione molten globule ? stato
denaturato è rapida e non cooperativa, mentre
linterconversione molten globule ? stato nativo
è lenta e cooperativa.
19
Fluttuazioni intorno allo stato nativo
20
Il numero di conformazioni possibili per un
polipeptide composto da n residui è
dove ? rappresenta il numero di conformazioni
popolato da ogni residuo. Lesponente (n-2) tiene
conto del fatto che i due residui terminali
restano comunque liberi in qualunque
conformazione.
Dallapprossimazione degli isomeri rotazionali
?9. Quindi per n100 (miniproteina)
21
Sperimentalmente si è trovato che in media
?3.5.
Assumendo ON1 per una proteina nel suo stato
nativo e calcolando la variazione entropica per
mole di proteina
La variazione di entropia conformazionale è di
ca. -2.4 calmol-1K-1 per residuo!
22
Paradosso di Levinthal
Ipotizzando che un sistema popoli ciascuna
conformazione per un tempo dellordine di 1 ps ci
vorrebbero ca. 61033 anni per analizzare tutte
le possibili conformazioni. Proteine (in vivo e
in vitro) raggiungono la conformazione nativa in
un tempo che varia tra 0.1 e 1000 secondi. Il
processo di folding deve essere un processo
guidato attraverso un cammino non casuale!
23
Meccanismi di folding
F Frazione di molecole che raggiungono
rapidamente lo stato nativo
1-F Frazione di molecole che raggiungono stati
metastabili (minimi locali di energia)
24
Processo a due stati
kD N ? D kF
Es. Lisozima
- kD e kF rappresentano rispettivamente le
costanti cinetiche del processo di denaturazione
(N?D) e del processo di folding (N?D). - Perché valga questo tipo di modello gli stati
intermedi devono essere tutti fortemente
instabili.
25
Da un punto di vista cinetico
Dividendo entrambi i membri per la concentrazione
totale N D
26
Introducendo la variazione delle frazioni molari
della forma nativa e denaturata dai valori di
equilibrio ?fN fN fN(eq) ?fD
fD fD(eq)
Allequilibrio kD fN(eq) kF fD(eq)
27
A tutti i tempi (conservazione di massa)
?fN - ?fD
La cui soluzione è
In un meccanismo a due stati la cinetica di
denaturazione e di folding avvengono con la
stessa costante cinetica ?.
28
Processo a più stadi
N ? X ? D
veloce lento
Es. Ribonucleasi
Lo stato intermedio X presenta regioni
strutturalmente ordinate che assumono la funzione
di centri di nucleazione attorno ai quali si
completa il folding proteico.
29
Il modello più semplice prevede un solo stato
intermedio k1
k2 N ? X ? D k-1
k-2
La soluzione dellequazione cinetica è
Le cinetiche di folding e unfolding per un
processo a tre stati non sono le stesse.
30
Modelli di folding
- Nucleazione e crescita rapida
- D ? I1 ? I2 ? I3 ? I4 ? I5 ? N
- Nucleazione (lenta) crescita
(rapida)
In questo modello vi è un primo evento di
nucleazione verso lintermedio corretto che
porterà alla strutturazione nativa. Questo primo
passo è lento e il processo di sampling delle
conformazioni casuale. Gli stadi successivi
(crescita) sono rapidi e portano
irreversibilmente alla struttura nativa.
31
B) Modello generale
U1
I1
intermedio pre-foldato (MG)
U2
stati unfolded
I2
N
I4
U3
struttura nativa
U4
I3
U5
stati intermedi
32
I
II
III
33
- Collasso veloce della catena proteica in una
conformazione compatta (Molten globule) - I tempi sono dellordine dei microsecondi.
- II. Esplorazione delle strutture compatte
- III. Transizione tra stati misfolded e struttura
nativa (lento)
La transizione tra stati misfolded e struttura
nativa è un processo attivato, generalmente
lento. Per una barriera di energia dellordine di
7 kcalmol-1, il tempo stimato necessario alla
transizione è dellordine di qualche secondo.
34
Collasso veloce
Processi attivati
Cinetica bifasica di un processo di folding