Presentazione di PowerPoint - PowerPoint PPT Presentation
1 / 9
Title:
Presentazione di PowerPoint
Description:
Title: Presentazione di PowerPoint Author: Anna Maria Girardo Last modified by: Annamaria Created Date: 9/22/2000 12:55:57 PM Document presentation format – PowerPoint PPT presentation
Number of Views:48
Avg rating:3.0/5.0
Title: Presentazione di PowerPoint
1
(No Transcript)
2
- C ??velocità luce
- ?C/?
- Eh? Emc2
- h?mc2
- Sostituzione di c con v(velocità generica)
- h?mv2
- ?v/?
- hv/?mv2
- ?mv2 hv
- Atomo BOHR e quantizzazione
- 1)gli elettroni girano in orbite circolari a
raggio ben definito - 2) Il momento angolare dellelettrone è
- quantizzato mvr nh/2?
- 3)lelettrone non perde né acquista energia
quando si trova nella stessa orbita. - Lenergia di un quanto è espressa dallequazione
di planck - Eh? hcost di planck
- ? frequenza
3
- Heisenberg Il principio di indeterminazione di
Heisenberg afferma che non si può conoscere
nello stesso istante la posizione e la velocità
dellelettrone in quanto esso ha una doppia
natura particella e onda per cui più è
indeterminata la posizione e più sarà determinata
la quantità di moto - ?p ?x?h
- ?p indeterminazione della quantità di moto
- ?x indeterminazione della posizione
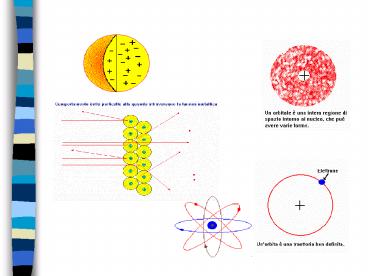
- DA ORBITA A ORBITALE
- SOLUZIONE DELLA FUNZIONE DI STATO DI SCHRODINGER
- NUMERI QUANTICI
- n
- l
- m
- ms
4
- Valori dei numeri quantici
- n da 0 a ?? indica il livello di E dellelettr.
- l da 0 a n-1 la forma dellorbitale.(dipende da
n) - m da l 0 l lorientamento nello spazio
dellorbitale(dipende da l e quindi da n) - ms numero quantico di spin (dallingl. To spin
ruotare). Indica il verso di rotazione
dellelettrone - GLI ELETTRONI E DI CONSEGUENZA GLI ORBITALI SONO
GOVERNATI DA QUESTI NUMERI QUANTICI.
5
- VALORI DEI NUMERI QUANTICI
n l m Tipi di orbitali
1 0 0 1s
2 0 1 0 -1,01 2s 2p
3 0 1 2 0 -1,01 -2,-1,0,1,2 3s 3p 3d
4 0 1 2 3 0 -1,0,1 -2,-1,0,1,2 -3,-2,-1,0,1,2,3 4s 4p 4d 4f In ogni casella si inseriscono 2 elettroni rappresentati con 2 frecce una rivolta verso lalto ed una verso il basso
6
(No Transcript)
7
(No Transcript)
8
- Configurazione elettronica
- Regola di haufbau (gli elettroni spontaneamente
occupano gli stati quantici disponibili a minor
energia) - Regola di hund (se più elettroni hanno lo stesso
contenuto energetico, essi tendono a disporsi
isolatamente nel maggior numero di orbitali
possibili, compatibili con quellenergia. - Principio di esclusione del Pauli (in un orbitale
possono esserci solo 2 elettroni a spin opposto
campo elettrico/ campo magnetico.
9
- Applicazione regole
- 1s-2s-2p-3s-3p-3d-4s-4p-4d-4f
- sltp ltd ltf
P(x)
P(y)
P(z)
Orbitali a stesso contenuto energetico