ELECTROFORESIS - PowerPoint PPT Presentation
1 / 40
Title:
ELECTROFORESIS
Description:
Capillary Electrochromatography (CEC. * Secuenciaci n de DNA M todo de Sanger automatizado Molde: 3 --G A A T T C G C T A A T G C ---5 Oligo: ... – PowerPoint PPT presentation
Number of Views:470
Avg rating:3.0/5.0
Title: ELECTROFORESIS
1
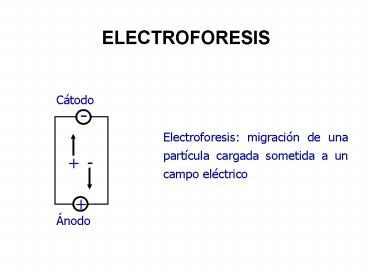
ELECTROFORESIS
Electroforesis migración de una partícula
cargada sometida a un campo eléctrico
2
ELECTROFORESIS
q
Velocidad E
f
E gradiente de potencial. EV/d q carga
eléctrica de la partícula (depende de pH) f
coeficiente de fricción tamaño forma
3
Criterios de separación electroforética
q (carga)
Velocidad E
f (tamaño, forma)
- Separación por tamaño
- Separación por carga
- Separación por tamaño y carga
4
ELECTROFORESIS
q (carga)
Velocidad E
f (tamaño, forma)
- Muestra
- Tampón mantenimiento de pH y conductividad
- Soporte
- Equipo electroforético
- Fuente de alimentación
- Cubeta de electoforesis
5
SOPORTES ELECTROFORÉTICOS
- Electroforesis libre (Arne Tiselius, 1937)
- En solución. Difusión, convección.
- Electroforesis de zona
- Soportes no restrictivos
- Papel, acetato de celulosa
- Almidón, agar, agarosa
- Soportes restrictivos
- Agarosa (ácidos nucleicos)
- Poliacrilamida
6
EQUIPOS ELECTROFORÉTICOS
Cátodo
-
-
Ánodo
7
Carga eléctrica de la biomoléculas
- Ácidos nucleicos
- Proteínas
8
Lehninger. Principios de Bioquímica
9
(No Transcript)
10
Electroforesis de ácidos nucleicos en geles de
agarosa
11
Electroforesis de ácidos nucleicos en geles de
agarosa
RNA
DNA genómico
DNA viral
12
ELECTROFORESIS MICROCAPILAR(Bioanalyzer(R))
Lab-on-a-Chip electroforesis miniaturizada y
automatizada
13
ELECTROFORESIS MICROCAPILAR(Bioanalyzer(R))
14
Electroforesis de ácidos nucleicos en geles de
agarosa
RNA
DNA genómico
DNA viral
15
Criterios de separación electroforética
q (carga)
Velocidad E
f (tamaño, forma)
- Separación por tamaño
- Separación por carga
- Separación por tamaño y carga
16
Electroforesis de ácidos nucleicos en geles de
agarosa
- DNA hebra doble condiciones no
desnaturalizantes - Tampón Tris/Borato/EDTA (TBE) o
Tris/Acetato/EDTA (TAE) - Muestra TBE o TAE, Glicerol, Azul de bromofenol
- RNA, DNA hebra simple condiciones
desnaturalizantes - Tampón MOPS formaldehído
- Muestra Formamida, Azul de bromofenol
17
Topología del DNA
Se aisló el DNA circular del virus SV40 y se
analizó por electroforesis en gel de agarosa. El
resultado se muestra en la calle 1. a) Por qué
se separa el DNA en una electroforesis en gel de
agarosa? En qué se diferencia el DNA de cada
banda? b) A continuación se incubó el DNA con
topoisomerasa I durante 5 min y se analizó por
electroforesis (calle 2). A que tipos de DNA
corresponde cada banda? c) Otra muestra se incubó
durante 30 min con topoisomerasa I. Qué
significa el hecho de encontrar más DNA de las
formas de movilidad reducida?
18
Electroforesis de DNA en geles de agarosa SSCP
single-strand conformation polymorphism
19
ELECTROFORESIS DE CAMPO PULSANTE(PFGE)
separación de moléculas de DNA de gran tamaño
- pulsed field gel electrophoresis
- FIGE field inversion gel electrophoresis
- TAFE transverse alternating field
electrophoresis - RGE rotating gel electrophoresis
- CHEF Contour-clamped homogeneous electric field
20
ELECTROFORESIS DE CAMPO PULSANTE(PFGE)
Rotating gel electrophoresis (RGE) separation of
3000 to 6000 kb DNA Schizosaccharomyces pombe
chromosomes. Run conditions 50 V, 1.4 V/cm, 100
hrs, 100 angle, concatamated multiple runs 2500
sec./50hrs, 3000 sec./50hrs, 0.5X TBE, 0.8
megarose (Clontech), 10 C.
21
ELECTROFORESIS DE CAMPO PULSANTE(PFGE)
Rotating gel electrophoresis (RGE) separation
Saccharomyces cercevisiae chromosomes (245-2190
kb). Run conditions 180 V, 5.1 V/cm, 34 hrs.,
120 angle, 60-120 sec. pulse ramp, 0.5X TBE, 1.2
GTG agarose, 10 C. Two combs were used on the
same gel to load 32 samples, a maximum of 72 are
possible
22
Hibridación de ácidos nucleicos Southern blot
gel
Nitrocelulosa
23
Hibridación de ácidos nucleicos Southern blot
- Transferencia a nitrocelulosa o nylon
- Hibridación con sonda específica radiactiva
- Lavado y autoradiografía
Autoradiografía
Electroforesis DNA
24
Southern blot RFLP Polimorfismo en la Longitud
de los Fragmentos de Restricción
Electroforesis DNA genómico
Autoradiografía
(A)
(B)
SONDA
EcoRI
EcoRI
EcoRI
(A)
(B)
EcoRI
EcoRI
25
Hibridación de ácidos nucleicos Northern blot
Electroforesis RNA
Autoradiografía
26
ELECTROFORESIS DE PROTEÍNAS DEL SUERO EN ACETATO
DE CELULOSA
Soporte no restictivo Separación por carga
27
ELECTROFORESIS DE HEMOGLOBINA EN ACETATO DE
CELULOSA
- Anemia falciforme
- Mutación en hemoglobina A
- Mutación GAG -gt GTG
- Glu -gt Val
28
ELECTROFORESIS DE PROTEÍNAS EN GELES DE
POLIACRILAMIDA CON SDS (SDS-PAGE)
29
(No Transcript)
30
Gel de empaquetamiento (3 PA)
Gel de separación (8-20 PA)
Soporte restrictivo Separación por tamaño
31
(No Transcript)
32
ELECTROFORESIS DE PROTEÍNAS EN GELES DE
POLIACRILAMIDA CON SDS (SDS-PAGE)
- Concentración de poliacrilamida
- Homogénea
- Gradiente
- Tampón de muestra
- Reductor (2-mercaptoetanol)
- No reductor
- Detección de las proteínas separadas
- Tinción (Azul Coomassie, sales de plata)
- Fluorescencia
- Inmunodetección
33
(No Transcript)
34
ISOELECTROENFOQUE
35
ELECTROFORESIS BIDIMENSIONAL
36
ELECTROFORESIS CAPILAR
- Electroforesis capilar de alta resolución (HPCE)
- Soporte capilar 7-100 cm, 20-200 micras de
diámetro - Voltaje gt500 V/cm
- Automatizada, gran resolución
- Detector Espectrofotómdetro, fluorímetro,
espectrómetro de masas
37
ELECTROFORESIS CAPILAR
- CZE de zona. Medio líquido, homogéneo,
capilares con carga uniforme - CGE en gel. Poliacrilamida, PA lineal,
metilcelulosa. - CIEF Isoelectroenfoque capilar.
- Isotachophoresis (ITP).
- Electrokinetic Chromatography (EKC).
- Micellar Electrokinetic Capillary Chromatography
(MECC OR MEKC. - Micro Emulsion Electrokinetic Chromatography
(MEEKC). - Non-Aqueous Capillary Electrophoresis (NACE).
- Capillary Electrochromatography (CEC.
38
(No Transcript)
39
Secuenciación de DNAMétodo de Sanger automatizado
Oligo 5--C T T A A
-
Molde 3--G A A T T C G C T A A T G C ---5
- DNA polimerasa - Nucleótidos dATP, dCTP,
dGTP, dTTP -Terminadores fluorescentes ddATP,
ddCTP, ddGTP, ddTTP
Separación de los fragmentos de DNA marcados,
mediante electroforesis capilar
5--C T T A A G -3
5--C T T A A G C -3
5--C T T A A G C G -3
5--C T T A A G C G A -3
Detector de fluorescencia
5--C T T A A G C G A T -3
láser
5--C T T A A G C G A T T -3
G C G A T T A C G . . .
5--C T T A A G C G A T T A -3
5--C T T A A G C G A T T A C -3
5--C T T A A G C G A T T A C G -3
40
CENTRIFUGACIÓN, CÁLCULO DE FUERZA CENTRÍGA
RELATIVA
- A qué fuerza centrífuga relativa equivalen, en
un rotor de 10 cm de radio, las siguientes
velocidades de giro? - 1.000 rpm
- 10.000 rpm
- 30.000 rpm
- 100.000 rpm