Buffers - PowerPoint PPT Presentation
1 / 45
Title: Buffers
1
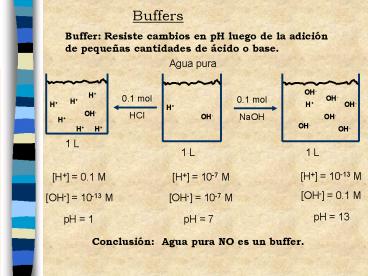
Buffers
Buffer Resiste cambios en pH luego de la adición
de pequeñas cantidades de ácido o base.
Agua pura
H 10-13 M
H 0.1 M
H 10-7 M
OH- 0.1 M
OH- 10-7 M
OH- 10-13 M
pH 13
pH 7
pH 1
Conclusión Agua pura NO es un buffer.
2
HAc 3.6x10-5 M
H 0.1 M
H 1.8x10-5 M
H 10-13 M
OH- 0.1 M
OH- 5.6x10-10 M
OH- 10-13 M
pH 13
pH 4.75
pH 1
Conclusión pH se puede ajustar por adición de
ácido o base débil pero no actúa como un sistema
buffer.
3
Buffers, tampones o soluciones reguladoras
- Soluciones de pares ácido base conjugados
- Resisten cambios de pH, incluso frente a la
adición de ácido/bases fuertes
4
Para forman un buffer, una solución debe contener
(1) Un ácido débil (HA) su base conjugada (A-)
Ejemplo HAc NaAc
(2) Una base débil (B) su ácido conjugado (BH)
Ejemplo NH3 NH4Cl
Ejemplo
HF ? F- H
NaF ? Na F- F- H2O ? HF OH-
5
Buffers, tampones o soluciones reguladoras
- Si una pequeña cantidad de hidroxilo se adiciona
a una solución equimolar de HF y NaF, HF
reaccionará con OH- para formar F- y agua
6
Buffers, tampones o soluciones reguladoras
- Si se adiciona ácido, entonces F- reacciona para
forma HF y agua.
7
Base fisicoquímica de la acción buffer
1.0 M HAc/1.0 M Ac-
H 1.8x10-5 M
pH 4.75
8
Ecuación de Henderson-Hasselbalch.
Adaptación de la ecuación de equilibrio de
disociación de un ácido útil para calcular el pH
de soluciones buffers.
HA ? H A-
9
Acido (HA) base conjugada (A-)
HA ? H A-
Base (B) acido conjugado (BH)
BH ? H B
Debe usarse pKa,
10
Factores que influencian el pH de soluciones
Buffer
1.- Dilución con agua
Buffer pH Valor de dilución
Tetraoxalato de potasio 1.68 0.19
Ftalato ácido de potasio 4.01 0.05
Borax 9.18 0.01
2.- Temperatura
11
Cálculo de pH luego de agregar Ácido o base a un
buffer
1.- Agregado de ácido
12
2.- Agregado de base
13
Cuando ácidos o bases fuertes se adicionan a un
buffer..
- es seguro asumir que todo el ácido o base fuerte
se consume en la reacción.
14
Ejemplo HAc ( Ka 1.8x10-5)
Considere 1 Litro de una solución que
contiene HAc 1.0 M y NaAc 1.0 M.
(a) Calcule el pH y H de la solución anterior.
pH 4.75 H 1.8x10-5 M
(b) Calcule el pH de la solución anterior
después de la adición de 0.10 mol de HCl.
pH 4.65 H 2.2x10-5 M (20 aumento)
(c) Calcule el pH de la solución (a) después de
la adición de 0.10 mol de NaOH.
pH 4.83 H 1.45x10-5 M (20
disminución)
15
HAc 1M / Ac- 1M
Preparar un buffer con un acido y su base
conjugada, se puede empezar por
(A) El ácido puro y luego agregar base fuerte
(ej. NaOH)
HAc OH- ? Ac- H2O
16
HAc 1M / Ac- 1M
(B) La base pura y luego agregar un ácido fuerte
(ej. HCl)
H Ac- ? HAc
17
Ejercicio 1 Determine el pH de la solución
resultante cuando se agregan 4,3 g de NH4Cl a 250
ml de NaOH 0.15 M. Kb NH3 1.8 x10-5 R.- pH 9.2
18
Capacidad Buffer (?)
Efectividad de un buffer para resistir cambios en
el pH luego de la adición de una base (o ácido)
se evalúa por su capacidad buffer (?)
En forma aproximada es el número de moles de base
(o ácido) que puede ser agregado a 1 L de
solución para obtener un cambio de 1 unidad de
pH (una disminución en H por un factor de 10)
Una ecuación más exacta es
C concentración total del buffer,
concentraciones molares del ácido y la base
19
Capacidad buffer y su dependencia del pH Buffer
HAc 1M /NaAc 1M (pKa 4.75)
pH ? pKa 1.15 pKa?0.5
0.84 pKa?1.0 0.38 pKa?1.5 0.14 pKa?2.0
0.05
Conclusiones (1) A Buffer más efectivo
cuando pH pKa
(2) Rango buffer útil es aproximadamente
pH pKa?1
20
Ejercicio 2 Cual es la capacidad Buffer
de una solución que contiene 0.36/L moles de
ácido Bórico y 0.28/L moles de borato de sodio a
pH Ka ácido Bórico 5.8 x 10 -10 a) 7,0 b)
9.24
R.- a) 0.0084 b) 0.37
21
Ejercicio 3 Si a una solución Buffer que
contiene 0.1 mol/l de formiato de sodio y 0.1 mol
/L de ácido fórmico se agregan 0.01 g/L de NaOH,
determine la capacidad Buffer de la solución
sobre el rango de pH. pKa Ac Formico 3.75
R.- 0.115
22
Buffer en sistemas biológicos y farmacéuticos
El pH del plasma sanguineo es de 7.4.
1) Plasma contiene ácido carbónico/bicarbonato y
ácido fosfórico/ fosfatos
HCO3- 0.025 M H2CO3 0.00125 M
Rango útil 6.2 lt pH lt 8.2
23
2) NaH2PO4 / K2HPO4 buffer fosfato (Sörensen)
pKa 7.2
H2PO4- ? H HPO42-
24
(3) Tris / HCl
TrisH ? H Tris
pKa 8.1
Rango útil 7.1 lt pH lt 9.1
(4) NaH2PO4 / K2HPO4 buffer fosfato (Sörensen)
H2PO4- ? H HPO42-
pKa 7.2
Rango útil 6.2 lt pH lt 8.2
Buffer preferido
25
Influencia del pH sobre la solubilidad de drogas
solc
HP
solid
HP
Û
-
P
O
H
O
H
sol
HP
3
2
disociada
no
forma
solubilidad
HP sol
S
o
equilibrio
el
En
-
P
O
H
3
K
a
HP
HP
K
-
a
P
O
H
3
-
HP
S
total
Solubilidad
P
S
por
HP
Sustituyendo
o
S
o
ka
S
S
o
O
H
3
ö
æ
Ka
ç
1
So
S
ç
O
H
ø
è
3
26
(No Transcript)
27
Ejercicio 4 Determine el pH bajo el cual una
solución de 1 g de fenobarbital en 100 ml a 25
ºC, comenzará a precipitar. La solubilidad máxima
de este fármaco es 0.0050 M y el pKa 7.41 a 25
ºC. MM de fenorbabital 254 g/mol R.- 8.24
28
Especies polipróticas y tampones
- Poseen más de un protón ácido
- Si la diferencia entre Ka para la primera
disociación y los valores subsecuentes Ka es 103
o mayor, el pH depende generalmente solo de la
primera disociación.
29
DIPROTICOS
H2A ? H HA- ? 2H A2-
Ka
Ka
Generalmente, Ka ltlt Ka HA- unido más fuerte
al protón que H2A neutro.
Acido carbónico
H2CO3 ? H HCO3- ? 2H CO32-
Solución exacta del sistema requiere la
determinación de 5 conc
(a) H2CO3 , (b) HCO3- , (c) CO32- , (d) H ,
(e) OH-
Solución de 5 ecuaciones 3 equilibrios
balance masa balance carga.
30
H2CO3 ? H HCO3- ? 2H CO32-
Simplificaciones
Debido a que
Ka gtgt Ka
H2CO3 - Considera solo
H2CO3 ? H HCO3-
CO32- H2O ? HCO3- OH-
Na2CO3 - Considera solo
31
H2A ? H HA- ? 2H A2-
EN GENERAL
Solo HA- pH ½(pKa pKa)
Si pH lt ½(pKa pKa) la solución contiene
H2A y HA-.
Si pH gt ½(pKa pKa) la solución contiene
HA- y A2-.
32
TRIPROTICOS Acido fosfórico
33
Diagramas de Ladder, especies en función del pH
a pH pKa, AHA
pH Especie principal
lt pKa HA
gt pKa A
pH especie principal especie principal
lt pKa1 lt pKa1 H2A
pKa1 lt pH lt pKa2 pKa1 lt pH lt pKa2 HA
gt pKa2 gt pKa2 A2
34
pH Major species
lt pKa1 H3A
pKa1 lt pH lt pKa2 H2A
pKa2 lt pH lt pKa3 HA2
gt pKa3 A3
35
(No Transcript)
36
Ejercicio 8 Cual es el porcentaje de
ionización del fenobarbital (pKa 7.48 a pH
2 y a pH 9?
37
Propiedades coligativas y significado biológico
Soluciones
Isotónicas
Hipotónicas
Hipertónicas
0.9 gr NaCl por 100 ml de solución
Determinación de la tonicidad
Depresión de la temperatura de congelamiento
Pedersen-Bjergaard Establecieron el punto de
congelamiento de la sangre humana y fluido
lagrimal. (- 0.52 ºC).
0.90 de NaCl
38
Cálculo de Tonicidad utilizando valores de Liso
? Tf i kf c
L i kf
? Tf L C
L varia con la concentración de la droga.
A una concentración de la droga que sea isotónica
con la sangre humana L es designado como Liso
39
Ejemplo para NaCl 0.90 (0.154 M) Liso ? Tf
0.52 3.4 C 0.154
Valores promedio de Liso
Tipo Liso Ejemplo No electrolitos
1.9 Sacarosa Electrolitos débiles
2.0 ácido bórico Electrolitos
uni-univalentes 3.4 NaCl Electrolitos
uni-trivalentes 5.2 Na3(PO4)
40
Métodos de ajustamiento de tonicidad
1.- Método equivalente de cloruro de sodio
(Mellen y Seltzer)
La cantidad equivalente de NaCl (E) o tonicidad
equivalente de una droga es la cantidad de NaCl
que es equivalente a 1 gramo de la droga
Sustancia MM E ?T 1 Liso Acido
ascórbico 176.12 0.18 0.11 1.9 Sulfato de
efedrina 428.54 0.23 0.14
5.8 Glucosa 198.17 0.16 0.09
1.9 NaCl 58.45 1.00 0.58 3.4
41
Cálculo de E
E 17 (Liso/ MM)
Ejercicio 5 a)Una solución que contiene 1.0 gr
de sulfato de efedrina en un volumen de 100 ml.
Que cantidad de NaCl debe ser agregada para hacer
la solución isotónica? Cuanta glucosa debería
ser requerida para este propósito? b) 2 gr de
sulfato de efedrina en un volumen de 200 ml.
R.- a) 0.67 g b) 1.34 g
42
2.- Método Crioscópico
0.52 ? Tf Solución isotónica
Ejercicio 5 Cuánto NaCl se requiere para hacer
a 100 mL de una solución al 1 de un fármaco
isotónico con el plasma? La solución al 1 del
fármaco reduce el punto de congelamiento en 0.08.
R.- 0.76 g
43
Ejercicio 7 29.53 ml de una solución contiene
291.6 mg de AgNO3 . Cuanto NaCl debe ser agregado
a esta solución para hacerla isotónica con
respecto a un fluido nasal. Asuma que el fluido
nasal tiene un valor de isotonicida de 0.9 de
NaCl. (E 0.33)
44
(No Transcript)
45
(No Transcript)