Diapositive 1 - PowerPoint PPT Presentation
1 / 25
Title:
Diapositive 1
Description:
Composition l mentaire moyenne d'une algue = (Redfield Ratio, 1958) ... Dans les sols biologiquement actif la pCO2 est plus lev e que dans l'atmosph re ! ... – PowerPoint PPT presentation
Number of Views:259
Avg rating:3.0/5.0
Title: Diapositive 1
1
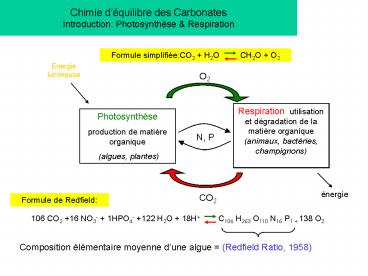
Chimie déquilibre des Carbonates Introduction
Photosynthèse Respiration
Formule simplifiéeCO2 H2O CH2O O2
Energie lumineuse
O2
Respiration utilisation et dégradation de la
matière organique (animaux, bactéries,
champignons)
Photosynthèse production de matière organique
(algues, plantes)
N, P
énergie
CO2
Formule de Redfield
106 CO2 16 NO3- 1HPO4- 122 H2O 18H
C106 H263 O110 N16 P1 138 O2
2
S4-T3 La pCO2 dans les sols
Diffusion du CO2 du sol en surpression par
rapport à latm.
pCO2 atmosphérique (10-3.5 atm.)
Infiltration de nutriments
Consommation des nutriments durant
linfiltration. Etage a activité respiratoire
maximale 1.5 m. Du fait, production de CO2
CH2O O2 gtgt CO2 H2O(CH2O ? mat. org.)Nota
activité biologique renforcée en été
Dans les sols biologiquement actif la pCO2 est
plus élevée que dans latmosphère ! Dans le
diagramme pCO2 sol max 0.007 atm. 10-2.atm
pCO2 sol 30 fois plus élevée que pCO2
atmosphérique.
3
S4-T4 pCO2 mondial des sols (valeurs
calculées)
Dans zones tropicales la pCO2 peut atteindre
10-1.4 atm. gtgt gt100 fois la pCO2 atm.
4
S4-T12 Un peu de chimie Spéciation du CO2 en
système fermé
HCO3- espèce dominante à pH ambiant appelé ion
bicarbonate ou hydrogénocarbonate
Transformation en fonction du pH pH lt 6.3
6.3 lt pH lt 10.3 pH gt 10.3
H2CO3 ? HCO3- ?
CO32- 1 H
1 H
Dans les eaux et sols à pH ambiant (pas trop
acide), le CO2 relargue un protonCO2 H2O gtgt
H2CO3H2CO3 gtgt HCO3- HEn milieu très
basique (pH gt 10) Le CO2 relâche son 2ème proton
HCO3- gtgt CO3- H
5
S3-T6 La Calcite une base
Dissolution Calcite CaCO3(s) gtgt Ca
CO3-2Exprimer la réaction en fonction de
lespèce carbonatée majoritaire crée HCO3-
dominant!!, donc Dissolution Calcite CaCO3(s)
gtgt Ca HCO3- - H Consommation protons,
Calcite base! En milieu naturel, apport continu
dacides non envisageable, dou nécessité de
neutralisation.
Respiration apport dacide (H2CO3 gt HCO3-
H) Dissolution Calcite Apport de base (CO32-
gt HCO3- - H)
S3-T6 La Calcite une base
Combinaison des équations de respiration et de
dissolution de la Calcite Dissolution Calcite
CaCO3(s) ? Ca HCO3- - H
réaction basique pH ?-
Dissociation CO2 CO2(g) H2O ? HCO3-
H réaction
acide pH ? Réaction résultante CaCO3(s)
CO2(g) H2O ? Ca 2 HCO3- réaction
'aprotique
Base Acide ?
produits aprotiques 7 lt pH lt 9
Combinaison dun acide faible à une base faible
On obtient un tampon pH Produits de
dissolution répondent à léquation 2 Ca
HCO3-
6
S4-T6 Vision chimiste de la formation dun
Karst
Milieux karstiques En surface Equilibre entre
photosynthèse et respiration, gtgt pas de
production excédentaire de CO2 gtgt Dissolution
conditionnée par la solubilité de la Calcite en
système ouvert (pCO2 10-3 atm.) Exemple
Lapiaze
Exemple Ensemble du Karst
En profondeur Exclusivement Respiration, donc
production excédentaire dacidité CaCO3(s)
CO2(g) H2O ? Ca 2 HCO3- réaction
'aprotique gtgt Dissolution conditionnée par le
système ouvert, à pCO2 plus élevée gt solubilité?
gtgt Dissolution préférentielle de la
Calcite en profondeur gtgt Génèse de grottes
souterraines, Dolines, chenaux découlements,
stalag(t,m)ites
7
S4-T7 Formation des Stalagmites Stalagtites
- Microfissure
- infiltration deau et de MO
- Respiration mauvaise aération , gtgtgt pCO2 ?,
Cadis ?, HCO3-dis ?
Surface Conduitaéré
- Conduit, gtgt bonne aération, pCO2 diminue gt
- gouttelette provenant dune microfissure collée
au plafond dégazage du CO2 gtgt précip.
Calcite gtgt stalagtite - gouttelette éclatant au sol nouveau dégazage
CO2 gtgt précip. Calcite gtgt stalagmite gtgtgtgt avec
le temps fermeture des chenaux ne conduisant
plus deau. - Galeries profondes inondées
- Dissolution épaulée par lérosion 'mécanique'
agents acide contenu dans leau de pluie.
8
Exercice
Pour leau minérale de Badoit, calculer le résidu
sec théorique et comparez-le aux données de la
bouteille. Vos conclusions ?
9
S4-T8 Karsts et qualité de leau de source
ELes eaux circulent dans des chenaux sur
différents niveaux, du fait Ø Circulation
rapide gtgt filtration peu efficace, gtgt
dégradation incomplète de la matière organique
gtgt problèmes de qualités de leau (germes
pathogènes, matières fécales, turbidité) gtgt
Traitement de leau ayant circulé dans ces
massifs Ø Système sensible aux crues gtgt
débit des sources variables, gtgt crues pièges
de spéléologues gtgt Qualité de leau très
variable (orage synonyme darrivées deaux
turbides). Ø Leau se fait rare en surface
gt peu de centres urbains sur les plateaux
(exemples massif du Vercors, Chartreuse)
Ø Difficile localisation de leau dans le
sous-sol a partir de la surfacegtgt recherche
d'eau fastidieuse, forage profonds.
Donc milieux sensibles par rapport aux
écoulements rapides et mauvaises filtrations du
sous-sol.Suite à cela, en exemple, interdiction
dinstallation de CET (centre denfouissment
tehcniques Décharges) sur des plateaux
karstiques risque dinfiltration des lixiviats,
et resurgences tel quel dans les sources.
10
S4-T9 Relation entre Ca et HCO3- dans les
rivières de la planète
La réaction de dissolution globaleCaCO3(s)
CO2(g) H2O ? Ca 2 HCO3- impose un
rapport fixe entre Ca et HCO3- pour les
eaux portant les produits de dissolution des
roches carbonatées
2 Ca HCO3- Les rivières du monde
saccomodent à cette condition témoignant de
lorigine principalement calcaire de Ca et HCO3.
Ca et HCO3- varient conjointement en
fonction de la pCO2 des eaux, souvent supérieure
à celle de latmosphère en fonction de la
respiration de la biomasse aquatique. Nota Une
molécule de Calcite dissoute pompe donc une
molécule carbonatée de latmsophère lors de la
dissolution.
11
S4-T10 Fontaines pétrifiantes
Les eaux souterraines sont en équilibre avec la
Calcite à la pCO2 élevée du sous-sol. gtgt
Précipitation de la Calcite suite à dégazage CO2
à la resurgence (pCO2 atm. plus faible).Cest la
réaction étudiée en sens inverse. CaCO3(s)
CO2(g)? H2O ? Ca 2 HCO3- Dégazage
favorisé par éclatement dune eau après chute.
Utilisé pour incruster de la Calcite sur des
objet touristiques.
12
S4-T11 Milieu fermé milieu ouvert
System ouvert La pCO2 est fixéeSystème fermé
La TCO3 (conc. totale des carbonates) est fixée.
13
S4-T13 Essai sur marbre (milieu fermé)
LEssai sur marbre est un test standard
permettant de juger létat de saturation par
rapport à la Calcite dune solution danalyse
(une eau naturelle ou potable en
exemple). Procédé Ajout de poudre de marbre
(Calcite) à la solution danalyse dans un flacon
fermé, et observer la variation en pH
CaCO3(s) ? Ca HCO3- - H
Dérive basique du pH en cas ou leau à dissout
de la Calcite Eau dite aggressive Pas de
variation pH significative si leau est en
équilibre avec la Calcite. Shift acide si leau
est incrustante (sur-saturée vis-à-vis de
Calcite, lapport de germes favorise la
précipitation ). Problèmes liés à Entartrage
des circuits de refroidissement dans les usines
en liaison avec solubilité? à T?. Entartrage
des conduites deau potable en liaison ou non
avec T. Incrustation de Calcite dans les tissus
textiles raccourcissement de la durée de vie.
14
S4-T14 Spéciation et solubilité du gaz CO2 en
système ouvert.
Exercice tracer le diagramme déquilibre
log(concentration des espèces carbonatées) en
fonction du pH, entre pH 2 et 12 - pour un plan
deau ouvert à latmosphère (pCO2 10-3.5
fixée).Quelques aides à la décision
Réflèchir laquelle des espèces H2CO3, HCO3-,
CO3-2 est indépendente du pH Tracer la droite
de cette espèce dans le diagramme Puis calculer
les concentrations des autres espèces et placer
les courbes de concentration dans le diagramme.
Tracer également les espèces H et OH- pour la
suite.On utilisera les constantes suivantes
H2CO3 ? HCO3- H pK1 6.3 HCO3- ?
CO3-2 H pK2 10.3 CO2(g) H2O
? H2CO3 KH(CO2)10-1.5 mol atm-1
15
S4-T15 Solution de lexercice CO2 système ouvert
Questions supplémentaires 1) On pose un
bécher deau pure sur une table. Que se
passe-t-il ? 2) Quel est le pH déquilibre ?
pH déquilibre dune eau de pluie estimée ? 3)
On ajoute de la base concentrée de quoi atteindre
pH 12. Que se passe-t-il ?
16
S4-T16 Solubilité de la Calcite
Définition du produit de solubilité (exemple
Calcite) CaCO3(s) ? Ca CO32 Ks
(Ca)(CO32-) 10-8.18
Le produit de solubilité nest pas une constante
de réaction (s dans Ks permet la
différenciation). Lire Si le produit des
activités mesurées (Ca)x(CO32-) dune solution
gt est supérieur à Ks on est en état de
sur-saturation il y aura précipitation,
(incrustation), gt est égal à Ks on est à la
limite de saturation il n'y a ni dissolution, ni
précipitation (équilibre), gt est inférieur à
Ks on est à l'état de sous-saturation en cas de
présence de grains de Calcite, il y aura
dissolution jusqu'à ce que le produit
(Ca)(CO32-) dans la solution soit égale à Ks
La solution est dite 'aggressive' du fait
qu'elle dissout de la Calcite. Pourquoi cette
'valeur limite de concentration' est exprimé par
le produit des activités des ions ?Parce que la
thérmodynamique (la définition des constantes de
réaction, de solubilité etc.) est basée sur la
théorie des solutions idéales considérant les
évenements de rencontre entre ionsen solution. Si
l'activité de (Ca) diminue d'un facteur 10, il
faudra augmenter (CO3-2) d'un facteur 10 pour la
même probabilité de rencontre de ions Ca et
CO3-2 en solution.
17
S4-T18 Exercices solubilité de la Calcite
- Calculer lindice de saturation de leau de
Badoit. - Placer la courbe de solubilité de la Calcite dans
le diagramme log-log des carbonates en milieu
ouvert. - Déterminer à laide du diagramme log-log
construit le pH déquilibre et Ca dun
mélange Calcite-CO2-H2O (pCO2 10-3.5 atm.).
Quel est le pH dun lac baignant dans un milieu
calcaire propre ?
18
S4-T19 Solution Exercice
pH déquilibre pH 8.3 Ca déquilibre
0.5 mmol/L Valeurs modèle dun lac calcaire.
- Aussi
- Caequil? dun facteur 100 par unité pH.
- La Calcite est un excellent tampon pH.
- La fouchette des variation des pH est faible.
Les sols et massifs calcaires ne sont pas
sensible aux pluies acides, quid à devenir acide
après dissolution compléte du massif calcaire
Des eaux acides peuvent être mesurés en fonction
dun manque de temps de dissolution.
log pCO2 -2.2 pHequil 7.7, log Ca
-2.75 (2 mmol/L(Ca)
Impuretés acides forts à pCO2-3.5,
pHequil-max 7.8 au lieu 8.3
19
S4-T20 Intégration des espèces hydrolysées
La solubilité totale du Ca dans leau est bien
sûr fonction de lensemble des espèces Ca
solubles dans leau Ca, CaHCO3 CaCO3(aq)
Ca(OH)
Ca2 CO3-2 H ? CaHCO3 logK3
11.33logK3 log(CaHCO3) - log(Ks) pH
car (Ca)(CO3-2) Kslog(CaHCO3) 11.33
log(Ks) pH 3.15 pHCa2 CO3-2 ?
CaCO3(aq) logK4 3.15logK4
log(CaCO3(aq)) - log(Ks) log(CaCO3) 3.15 8.18
-5.03 (constante Indép. pH)Ca2 H2O
? CaOH H logK5 -12.60logK5
log(CaOH) log(H) log(Ca) log(CaOH)
logK5 pH log(Ca) Rappel CaCO3(s) ?
Ca CO32 logKs -8.18
En conclusion La solubilité est contrôlée par
les espèces Ca (pHlt 9.5) et CaCO3(aq) (pH gt
9.5).Lespèce Ca contrôle la solubilité sur
tte la fourchette pH environnementale
20
S4-T21 pH déquilibre Calcite f(pCO2)
Conditions déquilibres atmosphériquespH8.3,
pCO210-3.5, Ca-10-3.3 mol/L
Le pH déquilibre dépend de la la pCO2 à
pCO2? pHequil ? et Caequil ? (pour
cause que la CO2 correspond à un apport dacide).
La solubilité des cations Ca ? est
naturellement augmentée en milieu plus acide.
Pour toute eau calcaire pH fixé à
7 lt pH lt 8.3 (pour pCO2 max de 10-2 supposée
en milieu tempéré).
21
S4-T22 pH déquilibre Calcite f(acide fort
ajouté)
Le pH déquilibre varie également en fonction
dacide fors ajoutés (ce qui équivaut des ajouts
dimpuretés acides présents dans les calcaires
naturels).
En système ouvert (- - -) la variation du pH est
très faible diminution de pH 8.3 à 8.0, au delà
il y a dissolution total du solide (pour pCO2
10-3.5).On confirme le fort effet tampon pH des
systèmes carbonatés en contact avec latmosphère.
22
S4-T23 Solubilités des carbonates de métaux
De la même façon on construira les diagrammes de
solubilités des ETM- carbonates (éléments traces
métalliques)Combiner la constante de solubilité
aux constantes de réaction des espèces
hydrolysées.
Exercice comparer les concentrations admises des
ETM dans leau potable aux solubilités de leur
carbonates. Conclusion ?
Cerrusite PbCO3(s) ? Pb2 CO3-2
logKs -13.13Espèces hydrolysées PbCO3(aq),
PbOH, Pb2OH3, Pb3(OH)42, Pb(OH)2(aq),
Pb(CO3)2-2, Pb4(OH)44, Pb6(OH)84, Pb(OH)3-
CuCO3(s) CuCO3(s) ? Cu2 CO3-2
logKs -9.63 Espèces hydrolysées CuCO3(aq),
Cu(OH)2, Cu2(OH)22, CuHCO3, CuOH, Cu(CO3)2-2,
Cu(OH)3-, Cu(OH)4-2 Smithsonite ZnCO3(s) ?
Zn2 CO3-2 logKs -10Espèces
hydrolysées ZnHCO3, ZnOH, ZnCO3(aq),
Zn(OH)2(aq), Zn(OH)3-, Zn(OH)4-2 Otavite
CdCO3(s) ? Cd2 CO3-2 logKs -13.74
Espèces hydrolysées CdHCO3, CdOH, CdCO3(aq),
Cd2OH3, Cd(CO3)2-2, Cd(OH)2(aq), Cd(OH)3-,
Cd(OH)4-2, Cd4(OH)44
23
S4-T24 Produits apparentés à la Calcite La Chaux
Le cycle de la chaux Décarbonatation
Calcaire Cuisson Chaux Vive dioxyde de
CarboneCaCO3 TC CaO CO2 Hydratation
Chaux vive Eau Chaux éteinteCaO
H2O Ca(OH)2 Recarbonatation Chaux éteinte
CO2(g) Calcaire EauCa(OH)2
CO2 CaCO3 H2O
Sous forme apportée, la Calcite, ou mieux encore
la chaux (obtenue a partir de la Calcite)
constitue un très bon matériel de piégeage des
métaux lourds. Ce sont des matériaux souvent
utiliser dans le cadre de stabilisation de sols
pollués, dans linertage de boues etc. Aussi ces
matériaux permettent de stabiliser le pH de sols
agricoles acides à des pH plus élevés ce qui
permet de meilleurs rendements agricols. Avec
le temps de la chaux apportée à un sol se
transformera en Calcite.
24
S4-T25 Produits apparentés Le Ciment
Portlandite Ca(OH)2(s) Constituant principal du
Ciment Ca(OH)2(s) 2 H ? Ca 2 H2O Ks
22.56 gtgt Caractère très basique, assure un pH bas
à lintérieur du béton.gtgt Extrèmement soluble,
une des cause pour la non-perennité de ce
matériau largement utilisé.gtgt Lexistence de la
Portlandite est liée à la cinétique de
dissolution lente.
25
Fin