Diapositive 1 - PowerPoint PPT Presentation
1 / 98
Title: Diapositive 1
1
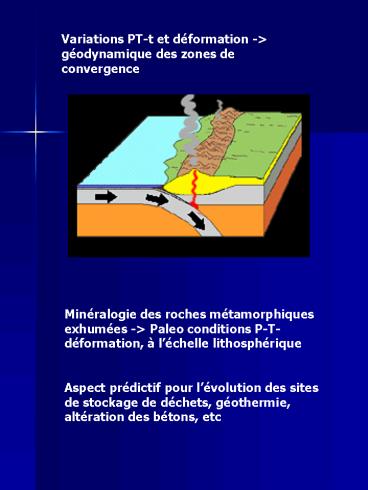
Variations PT-t et déformation -gt géodynamique
des zones de convergence
Minéralogie des roches métamorphiques exhumées -gt
Paleo conditions P-T-déformation, à léchelle
lithosphérique Aspect prédictif pour
lévolution des sites de stockage de déchets,
géothermie, altération des bétons, etc
2
Systèmes naturels -gt tendent vers un état
déquilibre
Roches T, P, déséquilibre chimique -gt
cristallisation de nlles phases plus stables,
pour minimisation E mais Persistance
dassemblage métastable bande denregistrement
des différentes conditions P-T vues au cours du
temps
3
Minéraux marqueurs de lévolution
PT-t-déformation
Quantification différents outils - simples
Calcul direct des conditions déquilibre (P-T)
des minéraux observés, minimisation dE pour une
composition donnée
4
Geothermometers semi-empiriques
5
Pas de revue exhaustive des différents outils
disponibles, mais discussion de la signification
de ces outils pour un système chimique simple
Si-Al-Mg-Fe-O-H -gt construction de grilles
pétrogénétiques, pseudo-sections, équations
déchange empiriquesetc pour les métapélites
alumineuse de HP-BT
6
Roches pélitiques alumineuses BT-HP
Roches hydratées gt très réactives dès les plus
basses températures Composition chimique assez
monotone Répartition spatiale assez continue Age
pouvant être estimé sans datation Déformation
plus évidente -gt Contraintes PT-t-déformation
-gt géodynamique à diférentes échelles
7
Approche géométrique
- Représentations 2-D des compositions chimiques
- Reconnaissance des réactions
- Calcul des pentes
- Variance, principes et diagramme de schreinemaker
8
système chimique avec beaucoup de constituants
? réduction omission des éléments qui nentrent
que dans une phase (de composition fixe) Après
Réduction SiO2 -Al2O3 -MgO -FeO- H2O
système FMASH Référence pour les métapélites
pauvres en alcalins, riches en aluminium. SiO2
-Al2O3 -MgO-H2O système MASH de référence,
expérimentation.
9
Principales phases dans ce système chimique à
BT-HP (gradient géothermique de 7-15
C/km) carpholite Car (Fe,Mg)Al2(Si2O6)(OH)4 s
udoite Sud (Fe,Mg)2Al3(Si3Al)O10(OH)8 chlorite
tri. Chl (Fe,Mg)5Al(Si3Al)O10(OH)8 clinochlore
Clin (Mg)5 daphnite Daph (Fe)5 chloritoide Cld
(Fe,Mg)Al2O(SiO4)(OH)2 grenat (prp-alm) Gt (Fe,Mg
)3Al2Si3O12 kaolinite Kln Si4Al4O10(OH)8 pyrop
hyllite Prl Si4Al2O10(OH)8 distène Ky SiAl2O5
Comment estimer les conditions P-T en
utilisant ces minéraux ?
10
Réactions facilement identifiables dans les
roches naturelles
Approche plus systématique comment faire
11
Détermination des réactions possibles Projection
depuis H2O ? ?P,TH2O tamponé par H2O en
exces H2O
SiO2
Qtz
MgO FeO
Al2O3
12
Détermination des réactions possibles Projection
depuis H2O ? ?P,TH2O tamponé par H2O en
exces H2O
Al2O3
Rappels ph, phc, C, composant en exces/
projection, tampon µ, système dégénéré, conodes
(tie-lines), détermination des réactions
possibles
13
Détermination des réactions possibles Projection
depuis H2O ? ?P,TH2O tamponé par H2O en
exces H2O
Al2O3
14
Détermination des réactions possibles Projection
depuis H2O ? ?P,TH2O tamponé par H2O en
exces H2O
Al2O3
15
Détermination des réactions possibles Projection
depuis H2O ? ?P,TH2O tamponé par H2O en
exces H2O
Al2O3
Système dégénéré à un deux composants
16
Détermination des réactions possibles Projection
depuis H2O ? ?P,TH2O tamponé par H2O en
exces H2O
Al2O3
Système dégénéré à un seul composant
17
Les réactions limitent des champs de stabilité
dans un espace P-T
A B C
Variance ( nbre de paramètres pouvant varier
indépend-ement en maintenant léquilibre)
V(ddl) C(indépendants) 2(P,T)
ph Attention aux systèmes dégénrés/ Examples
Système chimique MgO-SiO2-Al2O3-H2O
18
H2O
Al2O3
C 3, ph 4, V 3 2 4 1 gt ligne ds
espace P-T
19
H2O
Al2O3
C 2 (dégénéré), ph 3, V 2 2 3 1 gt
ligne ds espace P-T
20
H2O
Al2O3
C 1 (dégénéré), ph 3, V 1 2 3 0
gtpoint ds espace P-T
21
Réactions facilement identifiables dans les
roches naturelles, mais ne donnent pas
dindication claire sur les conditions P-T.
Nous ne pouvons caractériser que les conditions
P-T dune paragénèse assemblage en équilibre.
A B C
?
22
Condition déquilibre (phases de comp.
fixe) DrGP,T 0 DrHP,T (P-1)DrV - TDrSP,T
avec D produits réactifs H (J/mol)
enthalpie de formation d'un minéral à partir de
ses composants S (J/mol/K) entropie de
troisième loi de la mique (entropie
"calorimétrique contribution magnétique,
ordre-désordre) V (J/bar) volume molaire G
energie libre
Système chimique MgO-SiO2-Al2O3-H2O
23
S
(J/mol/K) V(J/bar/mol)
A-QUARTZ 41.460 2.2690
SILLIMANITE 95.93 4.9830
ANDALUSITE 91.4337 5.1470
KYANITE 82.43 4.4120
Carpholite 220
10.59
Chloritoid 132
6.86
Sudoite 390
20.51
Clinochlore 435
21.5
DrS/ DrV bar/K
DrV
DrS
Ky-And
And-Sill
Sill-Ky
-Obtention des volumes facile (raffinement de
paramètres de maille RX) -Entropies estimées
en sommant S minéraux de structure
proche Ssud Sclin Smusc - Sphlogopite
394.15 (isostruct.)
24
S (J/mol/K)
V(J/bar/mol)
A-QUARTZ 41.460 2.2690
SILLIMANITE 95.93 4.9830
ANDALUSITE 91.4337 5.1470
KYANITE 82.43 4.4120
Carpholite 220
10.59
Chloritoid 132
6.86
Sudoite 390
20.51
Clinochlore 435
21.5
DrS/ DrV bar/K
DrV
DrS
Ky-And
And-Sill
Sill-Ky
25
Principes de Schreinemaker Champ de stabilité
dun minéral ou assemblage limité par faisceaux
de réactions qui sintersectent avec des angles lt
180 De part et dautre de lintersection, partie
stable et partie métastable. Lextension
métastable de la réaction ph1 est contenue dans
le champ où ph1 est stable dans tous les
assemblages possibles
T
variance -gt point invariant 3 ph, courbe
univariante 2ph Nbre de points invariants nbre
de combinaisons de triplets parmis 3 phases
3!/3!(3-3)! 1 Nbre de courbe univariantes
3!/2!(3-2)! 3
26
S
(J/mol/K) V(J/bar/mol)
A-QUARTZ 41.460 2.2690
SILLIMANITE 95.93 4.9830
ANDALUSITE 91.4337 5.1470
KYANITE 82.43 4.4120
Carpholite 220
10.59
Chloritoid 132
6.86
Sudoite 390
20.51
Clinochlore 435
21.5
27
P
T
28
En fait, la relation (dDrGP,T)T DrV, ou
pour une transformation isotherme nest pas
vérifiée pour les gaz (H2O, CO2.) car grosse
variation de volume avec variation de pression
(dV/dP ltgt 0)
- Compression isotherme dun gaz
- idéal P V est constant
- PVnRT
RT ln (P2/P1)
29
GP, T G1,T DVsolids (P - 1) RT ln (P/1)
(isotherme)
Courbes de déshydratations PAS DES DROITES !!
P
T
30
GP, T G1,T DVsolids (P - 1) RT ln (P/0.1)
(isotherme)
Courbes de déshydratations PAS DES DROITES !!
31
Groupe I reprendre le schreinemaker car Prl
Ky Qtz H2O présent et car Cld Qtz H2O
Pas stable Courbes supplementaires Car Clin
Qtz Ky H2O Car prl ky clin H2O Car
Prl Sud Clin H2O Sud car ky Clin
H2O Sud prl ky clin H2O
P
Prl Ky Qtz H2O
T
32
Groupe II Activité dune phase ? Modèles
ioniques vs moléculaire Non idéalité Énergie de
mélange, énergie dexcès Solvus et
démixion Constante déquilibre White, W. M.
http//www.imwa.info/Geochemie/Chapters.HTML Spea
r, F.S. Metamorphic phase equilibria P-T-t
paths, Mineralogical society of America
MONOGRAPH. IBSN 0-939950-34-0
33
P
T
La mise à léchelle de notre grille P-T passe par
lacquisition des propriétés thermodynamiques de
toutes les phases qui nous intérrressent (S, V
mais également Hf, Cp, a et b) Acquisition des
propriétés thermodynamiques standard Approche
expérimentale encadrement de courbes
déquilibre
34
Mise a lechelle (MASH)
- Extraction des données thermodynamiques à partir
dencadrements expérimentaux - Influence de la substitution FeMg, coefficient
de partage - Pseudo-sections T-X
35
La mise à léchelle de notre grille P-T passe par
lacquisition des propriétés thermodynamiques de
toutes les phases qui nous intérrressent (S, V
mais également Hf, Cp, a et b) Acquisition
des propriétés thermodynamiques
standard Approche expérimentale encadrement
de courbes déquilibre
36
Acquisition des propriétés thermodynamiques
standard Approche expérimentale encadrement de
courbes déquilibre
37
P
Condition déquilibre DrGP,T 0 DrHP,T
(P-1)DrV - TDrSP,T ici DrGP,T gt 0 quand B C
stables, DrGP,T lt 0 quand A stable
T
38
(No Transcript)
39
Relations de phases calculées dans le système
MASH avec H2O et quartz en excès Voir TWEEQ
40
Jusquà présent, nous avons travaillé dans le
système chimique simplifié MASH Pourtant dans la
nature, on observe toujours des compositions de
minéraux Mg Fe Extrapolation depuis MASH vers
FMASH
41
Jusquà présent, nous avons travaillé dans le
système chimique simplifié MASH Pourtant dans la
nature, on observe toujours des compositions de
minéraux Mg Fe Extrapolation depuis MASH vers
FMASH
42
Pour des compositions Fe-Mg.
Mg A B C
Fe A B C
P
A B C
A B C
T
Quid des minéraux de composition intermédiaire ?
Systèmes chimiques MgO-SiO2-Al2O3-H2O
FeO-SiO2-Al2O3-H2O
43
Pour un modèle ionique idéal aj PsPi
(Xi)as s sites cristallographiques, i cation
dans le pôle pur (phc), a multiplicité du site
considéré. Activité du pôle pur 1 Carpholite
aCar XMg (1 site de multiplicité
1) Clinochlore Si3AlivAl,(Mg)5viO10(OH)8
aClin (XSi)3 XAliv (XMg)5 XAlvi (4 sites
différents)
44
Condition déquilibre DrGP,T 0 DrHP,T
(P-1)DrV - TDrSP,T RTlnK Etat standard ()
phase de composition pôle pur à 298K, 1 bar K
constante d'équilibre prenant en considération
la composition des minéraux et de la phase fluide
(activité des minéraux) K produit activités
des phc dans les ph de composition variable à la
puissance du coefficient stoichiométrique de la
réaction K P (a)n
Exemple Car Cld Qtz H2O Mg-car Mg-Cld
Qtz W K a(Mg-Cld)1.a(Qtz)1.a(W)1.a(Mg-car
)-1
Système chimique MgO-FeO-SiO2-Al2O3-H2O
45
DrGP,T 0 DrHP,T (P-1)DrV - TDrSP,T
RTlnK K P (a)n
Connu (encadrements expérimentaux)
Mg-car Mg-Cld Qtz W K
a(Mg-Cld)1.a(Qtz)1.a(W)1.a(Mg-car)-1
Pour calculer le déplacement en température de la
courbe déquilibre, il faut connaître les
activités, et donc les compositions de Cld et Car
à léquilibre (partage entre Fe-Mg entre les deux
Mx)
46
Calibrationà partir de données naturelles
(XMg/XFe)car KD.(XMg/XFe)Cld
47
MgCar FeCld FeCar MgCld
DrGP,T 0 DrHP,T (P-1)DrV - TDrSP,T
RTlnK K a(MgCar).a(FeCld)/a(FeCld)/a(MgCld) D
ans le cas simple de Car et Cld (1seul site de
multiplicité 1 où Fe et Mg se subsituent), on
obtient K (XMg)car.(XFe)cld/(XFe)car/(XMg)cld
avec (XMg XFe)Car (XMg XFe)Cld 1 KD
Donc KD f(T,P)
48
Détermination en utilisant des données naturelles
49
Application numérique phyllite-quartzite de
crète
Calcul de XMg(Cld), Clin Sud pour XMg(Car)
0.8 XMgCar 0.8 ? aMgcar (0.8)1 XMgCld
0.36 (Kdcar/cld7) ? aMgCld (0.36)1 XMgClin
? (Kdcar/clin1.1) ? aClin ? XMgSud ?
(Kdsud/clin 2) ? asud ? MgCar MgCld
Qtz H2O ? Keq ? Clin 4 Prl 14 Qtz 5
Mg-Cld 3 H2O ? Keq ?
50
Calcul de XMg(Cld), Clin Sud pour XMg(Car)
0.8 XMgCar 0.8 ? aMgcar (0.8)1 XMgCld
0.36 (Kdcar/cld7) ? aMgCld (0.36)1 XMgClin
0.78 (Kdcar/clin1.1) ? aClin (0.78)5
0.29 XMgSud 0.88 (Kdsud/clin 2) ? asud
(0.88)2 0.77 MgCar MgCld Qtz H2O ?
Keq 0.36/0.8 Clin 4 Prl 14 Qtz 5 Mg-Cld
3 H2O? Keq 0.365/0.29
51
(No Transcript)
52
W
E
E-Crète Schistes rouges à hématite Sud(0.85)
Qtz Schistes noirs
Chl(0.35) Prl W-Crète Car(0.7-0.8)
Cld(0.2-0.35) Chl(0.75) Cld(0.1)
Chl(0.4)
53
12kbar 400C
5kbar 350C
54
Influence de la composition de la roche sur la
minéralogie et la composition des minéraux T-X
ou P-X
P
T
T
Cld Qtz Chl ou Prl
Chl Prl Qtz
Température
Sud Qtz Chl ou Prl
0
1
XMg des différentes phases
55
(No Transcript)
56
(No Transcript)
57
Système FMASH
- Approche multi-équilibre un point P-T pour des
paragénèses à variance élevée - Thermomètres empiriques
58
Système chimique MgO-FeO-SiO2-Al2O3-H2O
Jusquà présent, nous navons utilisé que les
propriétés thermodynamiques des pôles purs
magnésiens Mais on pourrait également utiliser
celles des pôles purs ferreux
Pour des compositions fixées
59
Système chimique MgO-FeO-SiO2-Al2O3-H2O
0.9
0.6
0.4
XMgcar
0.2
0.1
0.1
0.4
XFeCar
0.9
Variance de la paragénèse Car Cld Qtz H2O
3 2 4 1 dans MASH (une ligne univariante) 4
2 4 2 dans FMASH (une ligne divariante)
car 2 variables peuvent être modifiées
indépendement parmis composition, P, T tout en
maintenant léquilibre
60
- Donc il est possible de définir un point P-T où
les équilibres sintersectent, même pour des
paragénèses de variance gt 0. - Cela nécessite davoir plusieurs phases qui sont
des combinaisons linéaires de différents phc. La
position de ce point dépend de la composition des
phases - pour phc Fe-, Mg-car, Fe-, Mg-Cld, Qtz, H2O
6 RI 6 4 2 eq. Indépendants - Pour phc Mg-car, Mg-cld, Qtz, H2O 4, RI 1
61
Géothermomètres
Réactions déchanges A B A B Utilisées
comme de thermomètres empiriques
62
MgCar FeCld FeCar MgCld
DrGP,T 0 DrHP,T (P-1)DrV - TDrSP,T
RTlnK K a(MgCar).a(FeCld)/a(FeCld)/a(MgCld) D
ans le cas simple de Car et Cld (1seul site de
multiplicité 1 où Fe et Mg se subsituent), on
obtient K (XMg)car.(XFe)cld/(XFe)car/(XMg)cld
avec (XMg Xfe)Car (XMg Xfe)Cld 1 au
coefficient de partage Mg-Fe entre Car et Cld
(Kd)
Pour les réactions déchange, DrV 0, donc 0
DrHP,T - TDrSP,T RTlnK Soit DHP,T - DSP,T
lnK A/T B RT R
Quand T aumente, lnK diminue et tend vers 1, car
à hte T, la distinction énergétique de Fe et Mg
pour le même site dimiminue.
63
A partir de données naturelles partage Fe-Mg
entre chlorite et chloritoide, Vidal et al (1999)
calibré à partir de données naturelles
T1
T2
ln(XFe/XMg)Cld
ln(XFe/XMg)Car
64
Calibration expérimentale exempleGt-Bt à 20
kbar (Ferry and Spear, 1978)
lnKD -2108 T(K) 0.781
65
lnKD -2108 T(K) 0.781 (Ferry Spear, 78)
66
Application au système naturel
- Notion déquilibre local dans un système en
déséquilibre - Quantification dun chemin P-T continu à laide
de paragénèses à Chl-Phg - Cartes P-T sur lame mince
- Equilibre-desequilibre et transport par
diffusion approche expérimentale sous gradient
de T
67
Estimations P-T basées sur lhypothèse de
déquilibres thermodynamiquespourtant
réactions minéralogiques en réponse aux
déséquilibres
- Pas contradiction, car même dans des systèmes en
évolution P-T, on peut approcher les conditions
déquilibre localement - équilibre local f(espace temps)
68
Espace -gt gradients
Qtz H2O H4SiO4
C
C
C
P
H4SiO4
P
distance
69
Temps -gt coexistence de paragénèses successives
- Scarcity of low variance parageneses -gt poor
resolution of the P-T conditions (P-T fields)
- Risk when using several samples attempt to
constrain one P-T path from samples which
underwent different P-T histories
70
500 µm
71
Caractérisation et quantification de lévolution
minéralogique, transport de matière et
déformation
- Méthode destimation des conditions P-T avec une
haute résolution spatiale et temporelle, même
pour des paragénèses à forte variance - Equilibres multiples utilisant des assemblages à
Chl et Phg
- Trajets P-T dexhumation continus
- Cartes P-T
II. Experiences sous gradient thermique
Equilibre-déséquilibre et transport de masse
dans un système clos
72
Multiequilibrium calculation
Independent reactions
End-members Components
Increasing the number of end-members ?
simultaneous estimation of P and T for high
variance parageneses
- Potential candidates chlorites and white micas
- Several substitutions described with several
end-members - Common in rocks of various composition
- Stable over a wide range of P-T conditions
- Composition depends on P-T conditions
73
Chlorites
74
Phengites
Muscovite Si3Al Al2 ? K Celadonite
Si4 Al(Fe2,Mg) ? K Paragonite
Si3Al Al2 ? Na
75
Chlorite quartz V 3 in MASH
RI 1
76
Cld Chl Qtz H2O
Dispersion maximale compatible avec lhypothèse
déquilibre ?
Si on considère que les données thermodynamiques
sont parfaites, la dispersion est due
aux Incertitudes sur les analyses microsondes
Erreurs sur les minéraux que lon pense être en
équilibre
77
Cycladic Blueschists (Tinos) Local equilibrium at
the thin section scale
78
Cycladic Blueschists (Tinos) Local equilibrium at
the thin section scale
79
Vidal Parra (2000), Parra et al. (2002b)
80
(No Transcript)
81
- La variabilité de composition chimique des
phyllosilicates -gt trajet P-T-(t?) CONTINU
contraint à laide de paragénèse à forte variance
- Echelle dobservation similaire à celle des
géologues structuraux - Lien entre déformation et conditions P-T
82
P-T-deformation mapping Upper Gt-bearing unit
Sambagawa (Japan)
Si, Al, Fe, Ca, Na, K Raw data -gt quantitative
analyses
Standardization using point analyses
83
Multi-equilibrium technique
T estimate for each Chl pixels
84
Blue Schists, Sambagawa
T C
Map of temperature
Chl Pg Ab Qtz
85
(No Transcript)
86
comparison with the structures (still to be done)
t3
87
- Rate of growth
- -gt rate of deformation
88
Redox (fugacité doxygene)
Prédit Mesuré (XANES) (thermo)
89
Discontinuité de la déformation
90
Chlorite mica
91
(No Transcript)
92
Application au stockage de déchets
radioactifs Expérience Fe métal matrice
argileuse aggrégats argileux pendant 3.2 ans à
25 C
Modélisation -gt contrainte sur les cinétiques de
transport (notamment coéfficients de diffusion)
93
Deuxième conclusion Les variations de
composition des phyllosilicates -gt cartes P-T-(t)
et flux de matière
94
Local equilibrium-global disequilibrium and mass
transport Experiments under a thermal gradient
?T ? ?µ ? Diffusion
95
diffusivity of Al depends on its speciation
96
Le transport par diffusion, dans un système
clos, entre domaines en équilibre local ne
doit pas être négligé
- Moteur de la diffusion dans les roches
métamorphiques - gradients de P (déformation), composition
- Changements de phase
97
Jd
Pg Qtz Na
Jd Qtz Ab
Ab
Favorable site of nucleation vein walls,
pressure shadowsetc
98
- Triple approche
- Observations naturelles
- Thermodynamique
- Expérimentation
- -gt Quantification de lhistoire
P-T-déformation-redox des roches métamorphiques
et contraintes géodynamiques à échelle
lithosphérique - -gt prédiction du devenir de stockages de déchets
radioactifs, ou sites géothermiques.