Atombau - PowerPoint PPT Presentation
1 / 17
Title:
Atombau
Description:
Atombau Atome bestehen aus noch kleineren Bestandteilen, den sog. Elementarteilchen Atomh lle aus mehreren Schalen Atomkern Alle Materie ist aus den gleichen ... – PowerPoint PPT presentation
Number of Views:226
Avg rating:3.0/5.0
Title: Atombau
1
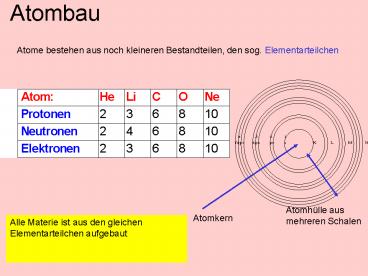
Atombau
Atome bestehen aus noch kleineren Bestandteilen,
den sog. Elementarteilchen
Atomhülle aus mehreren Schalen
Atomkern
Alle Materie ist aus den gleichen
Elementarteilchen aufgebaut
2
Grundlegende Versuche
Wie kommt man zur Ansicht, Atome bestehen aus
Elementarteilchen, aus Kern und Hülle und die
Hülle aus verschiedenen Schalen?
1. Versuch Atome bestehen aus Elementarteilchen
-
a -Strahlung
Ladung
keine Ladung
c-Strahlung
b-Strahlung
- Ladung
Atome sind teilbar und bestehen aus mind. 3
verschiedenen Teilchen
3
Kern und Hülle
Wenn a-Strahlung durch eine Goldfolie hindurch
geht (ohne diese zu zerstören, müssen grosse
Zwischenräume bestehen.
Atome bestehen aus einem Kern und einer grossen
Leere
4
Aufbau der Atomhülle
Absorption
Emission
5
Erklärungsversuch
6
Atomgröße
Öl ist hydrophob und mischt sich praktisch nicht
mit Wasser
Ein einzelner Öltropfen verteilt sich
gleichmässig auf der Wasseroberfläche
Höhe der Scheibe Länge eines Ölmoleküls
Öltröpfchenversuch
1 ml Öl in 99 ml Benzin
Ein Ölmolekül besteht aus 18 Kohlenstoffatomen
100 Tropfen Mischung 1 ml
1 Tropfen Mischung wird auf das Wasser gegeben
Benzin verdampft. Zurück bleibt das Öl
Welchen Durchmesser besitzt ein Kohlenstoffatom ?
Der Ölfleck wird gemessen
Die Höhe der entstehenden Scheibe wird berechnet
7
Messung der Atomgrösse
Durchmesser
Höhe
Die berechnete Höhe entspricht der Länge eines
Ölmoleküls (d.h. 18 Atome Kohlenstoff)
8
Atommodell nach Niels Bohr
Schale Nr Unterschale K 1 1s L 2 2s 2p M 3 3
s 3p 3d N 4 4s 4p 4d 4f etc.
eZn 2 n2
9
Widerspruch
Wenn Elektronen wie Satelliten um den Atomkern
kreisen würden, Müssten sie irgendwann in den
Atomkern stürzen
Das tun sie aber nicht!!
10
Atomorbitale
s-Orbitale
p-Orbitale
d-Orbitale
11
Energiniveau
Das s-Orbital der 4ten Schale ist energetisch
tiefer als das d-Orbital der 3ten Schale
4s
3. Schale
3d
4. Schale
12
Energiniveau 2
Ab der 3. Schale überlagern sich die Schalen
13
Hundsche Regel
Bei Atomorbitalen gleicher Energie (z.B. den
3p-Atomorbitalen) wird jedes Orbital zuerst nur
mit einem einzigen Elektron besetzt (geringere
Wechselwirkungen!) HUND'sche Regel
14
Isotope
Die meisten Elemente kommen mit unterschiedlicher
Neutronenzahl In der Natur vor. Beispiel die
Isotope des Elements Sauerstoff
Man unterscheidet total rund 1500 verschiedene
Isotope
15
Das Periodensysten
farb-
und geruchlose Gase, die mit anderen Stoffen
kaum reagieren
Edelgase
36
18
10
2
weiche Metalle, die an der Luft oxidieren und mit
Wasser heftig reagieren
Alkalimetalle
37
19
11
3
härter als Alkalimetalle, verbrennen unter heller
Flamme
38
20
12
4
Erdalkalimetalle
farbige, sehr reaktive Gase
Halogene
53
35
17
9
16
Das Periodensystem 2
17
Das Periodensystem 3