G - PowerPoint PPT Presentation
1 / 55
Title:
G
Description:
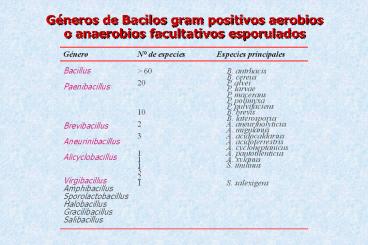
G neros de Bacilos gram positivos aerobios o anaerobios facultativos esporulados G nero N de especies Especies principales Bacillus Paenibacillus – PowerPoint PPT presentation
Number of Views:156
Avg rating:3.0/5.0
Title: G
1
Géneros de Bacilos gram positivos aerobios o
anaerobios facultativos esporulados
Género
N de especies
Especies principales
- Bacillus
- Paenibacillus
- Brevibacillus
- Aneurinibacillus
- Alicyclobacillus
- Virgibacillus
- Amphibacillus
- Sporolactobacillus
- Halobacillus
- Gracilibacillus
gt 60 20 10 2 3 1 1 1 3 2 1
B. antrhacis B. cereus P. alvei P. larvae P.
macerans P. polimyxa P. pulvifaciens B. brevis B.
laterosporus A. aneurinolyticus A. migulanus A.
acidocaldarius A. acidoterrestris A.
cycloheptanicus A. pantothenticus A. xylanus S.
imilinus S. salexigens
2
Bacilos gram positivos regulares
Esporas Bacillus spp Esporas -
BGP regulares
catalasa
Metabolismo
- SH2 (TSI)
Oxidativo Kurthia spp
Fermentativo Listeria spp
- Lactobacillus spp
Erysipelothrix
3
Género Bacillus
- BGP regulares esporulados
- Aerobios o anaerobios facultativos
- Catalasa usualmente
- Motilidad por flagelos peritricos (mayoría de
las especies) - Metabolismo fermentativo o respiratorio
- Crecen en amplios rangos de temperatura (hasta
75C) y pH (2 a 10) - Colonias grandes, grises o blancas, de bordes
irregulares, con b hemólisis (B. anthracis no
presenta b hemólisis) - Hábitat suelo, agua, polvo. Algunas especies
forman parte de la flora normal del intestino
humano y de animales
4
Coloración de Gram B. cereus
5
B. mycoides
6
B. mycoides
7
Bacillus sp
8
Bacillus sppHabitat natural
- ? Medio Ambiente suelo de todo tipo
- clima cálido - frío
- áreas fértiles - desiertos
- agua dulce - salada
? Esporos Pueden permanecer por muchos años en
el ambiente inanimado (esporas de
Pasteur gt 70 años) Son resistentes al
calor (10 5 más veces que su forma
vegetativa), a la irradiación (7 a 50 veces más
que la forma vegetativa) y a algunos
agentes químicos Pueden pasar del medio
ambiente a otros habitats
alimentos secos (leche en polvo, especias,
farináceos)
9
Bacillus spp. Patogenicidad
- ? Patógeno obligado Bacillus anthracis
- ? Patógenos oportunistas la mayoría de las
especies
? Débil poder patogénico ? Requieren tanto de una
puerta de entrada como de un sistema inmune
comprometido para producir enfermedad ? Tipo de
infección predominante (excluyendo la
bacteriemia) la neumonía, muchas veces con
complicaciones sépticas ? Modo de transmisión
por inhalación de esporas ? Especies más
frecuentes 1 B. cereus, 2 B. subtilis.
Otras especies (menos frecuentes) B. circulans,
B. pumilis, B. licheniformis, B. coagulans,
B. sphaericus
10
(No Transcript)
11
Bacilos gram positivos esporulados, aeróbicos
lecitinasa
- B. cereus
- B. anthracis
- B. thurigiensis
- B. mycoides
Motilidad
B. cereus B. thurigiensis
- B. anthracis B. mycoides
Cristales paraesporales de toxina con acción
insecticida
Salicina / glicerol
- / - B. anthracis (g hemólisis colonia
lisa)
/ B. mycoides (b hemólisis colonia
rugosa)
B. thurigiensis
- B. cereus
12
Cell of B. thurigiensis containing a d-endotoxin
crystalline inclusion (arrow) and a forespore (S)
13
Caracteres mínimos para diferenciar B. anthracis
de B. cereus
B. anthracis
B. cereus
- Morfología
- Motilidad
- Cápsula
- ß hemólisis
- Sensibilidad a penicilina
- Fermentación de salicina
Bacilar, extremos rectangulares, cadenas
largas - - S -
Bacilar, extremos redondeados, cadenas cortas /
- - R
14
Antrhax Etiology
15
Anthrax
- ? Etiología Bacillus anthracis
- ? Infección primaria en herbívoros (ganado,
ovejas, cabras, caballos) por ingestión de
esporas del suelo. - ? Anthrax humano
- ? por contacto directo o indirecto (pelo,
piel, lana) con el animal - infectado forma típica
- ? por exposición intencional forma atípica
- ? Tres formas clínicas
- ? Cutánea
- ? Inhalatoria
- ? Gastrointestinal
- ? Transmisión hombre - hombre y animal - animal
(misma especie) extremadamente infrecuente
16
Epidemiología del anthrax en el siglo XXI
- ? Industrial por el procesamiento de
productos animales contaminados - pelo, hueso, piel, lana (anthrax cutáneo e
inhalatorio) - ? No industrial
- ? Intencional / bioterrorismo por
exposición inhalatoria y cutánea a esporas - de B. anthracis (correspondencia)
Por contacto directo con el animal infectado o su
cadáver (anthrax cutáneo o gastrointestinal) Pers
onal de laboratorio en contacto con esporas de
B. anthracis (raro) Personal civil expuesto a
productos animales importados contaminados (raro)
17
(No Transcript)
18
Anthrax cutáneo
- ? Período de incubación 1 12 días
- ? Pápula vescículas úlcera necrótica negra
(escara) - ? Pueden estar presentes edema y enrojecimiento
- ? 95 a 99 de los casos de anthrax humano en el
mundo - ? Mortalidad sin tratamiento ATB 20
- con tratamiento ATB 1
19
(No Transcript)
20
Anthrax cutáneo
21
Anthrax cutáneo
22
(No Transcript)
23
(No Transcript)
24
(No Transcript)
25
- Lecitinasa
26
Anthrax respiratorio
- ? Por exposición a piel, lana u otros productos
animales contaminados con esporas - (durante su procesamiento) o por exposición
intencional (bioterrorismo) - ? Período de incubación 1 - 7 días (hasta 42
días en algunos casos) - 1- Cuadro inespecífico (simil viral) fiebre,
mialgias, fatiga, tos, malestar y dolor de pecho - 2- Mejoría de 2 ó 3 días
- 3- Hipoxia, disnea, shock séptico y muerte dentro
de las 36 horas (fase final) - ? Hallazgos físicos no específicos
- ? Rx de tórax - ensanchamiento mediastinal
- - derrame pleural
- - mediastinitis hemorrágica
necrotizante - - ausencia de infiltrados
pulmonares - ? Meningitis en el 50 de los casos
- ? Mortalidad sin tratamiento 97
- con tratamiento 75
27
(No Transcript)
28
(No Transcript)
29
Anthrax gastrointestinal
- ? Por ingestión de carne contaminada
insuficientemente cocida - ? Período de incubación 1 - 7 días
- ? Dolor abdominal vómitos de sangre o diarrea,
fiebre, ascitis - masiva y signos de septicemia (fase final)
- ? Ulceraciones orofaríngeas con adenopatía
cervical y fiebre - (algunos casos)
- ? Mortalidad 25 - 60 (rol del tratamiento
antibiótico - precoz no establecido
30
AnthraxToma de muestra
- ? Anthrax cutáneo
- - Hisopado del exudado de las vescículas
destechadas (lesiones tempranas) - - Hisopado del borde de la escara sin remoción
de la misma (lesiones tardías) - - Hemocultivo si hay presentes síntomas de
infección sistémica - ? Anthrax gastrointestinal
- - Coprocultivo fase temprana
- - Hemocultivos fase tardía
- - Cultivo de líquido peritoneal y / o de
aspiración de nódulos linfáticos, esplénicos - o mesentéricos
- - Hisopado de fauces (lesiones orofaríngeas)
- ? Anthrax respiratorio
- - Esputo si el paciente tiene tos
productiva - - Hemocultivos 2 a 8 días después de la
exposición
31
Anthrax y Bioseguridad
- ? Procesamiento de muestras clínicas
- ? Manipulación del cultivo
- ? Actividades que generan aerosoles
- ? Procesamiento de muestras ambientales (esporos)
- ? Actividades con la toxina
- ? Dosis letal 50 8000 - 40000 esporas
BSL - 2
BSL - 3
32
AnthraxProcesamiento de muestras
- ? Muestras clínicas no esporas (CO2
corporal inhibe la esporulación) no shock térmico - ? Muestras ambientales (polvo, pelo, hueso y
suelo) presente en forma de esporas
- shock térmico (baño de agua a 65 C
10) ó shock alcohólico (etanol 95 - 100) - ? Siembra agar sangre ovina (o agar chocolate)
- - agar feniletilalcohol (coprocultivo)
- - caldo tripticasa soya
- ? Incubación 35 - 37 C, atmósfera ambiente, 18
- 24 hs (crecimiento visible a partir de las - 6 a 8 hs)
- ? Esporulación Agar nutritivo con 5 mg de sulfato
de manganeso - Incubación atmósfera ambiente
- Coloración de Gram ó Coloración de Verde de
malaquita (Wirtz - Conklin) - ? Cápsula Agar nutritivo con 0.8 de bicarbonato
de sodio - Incubación 5 CO2
- Tinta china ó MFadyean
- Colonia sospechosa en 2.5 ml de sangre de
caballo - Incubación 6 - 18 hs a 37 C
- Tinción de MFadyean
33
Criterios de laboratorio para la identificación
de Bacillus anthracis
- Identificación presuntiva
- 1) A partir de la muestra clínica
- - Coloración de Gram Bacilos gram positivos
en cadenas cortas - - Tinta china cápsula
- - Esporas generalmente ausentes (a menos que
la muestra sea expuesta al O2 atmosférico) - 2) A partir del cultivo (AS ovina)
- - Gram BGP no capsulados en cadenas largas
- - Verde de malaquita esporas ovales,
centrales o subterminales que no ensanchan la
célula - - Morfología colonial colonia gris o blanca,
adherente, lisa o ligeramente convexa con
proyecciones en forma de coma desde el borde de
la colonia (cabeza de Medusa) - Cuando la colonia se levanta con el ansa tiene la
apariencia de una yema de huevo batida - - Inmóvil
- - No hemolítico
- - Lecitinasa
- - Sensible a penicilina 10 U 15 - 20 mm
34
(No Transcript)
35
Bacillus anthracis on agar
36
Bacillus anthracis colonial morphology
37
Bacillus anthracis spore and veg form-gram stain
38
Wound smear
39
Capsule formation of B. anthracis colonies
incubated in a high CO2 environment
40
Criterios de laboratorio para la identificación
de Bacillus anthracis
- Identificación definitiva
- ? Presencia de la cápsula (Tinta china o
MFadyean) - ? Sensibilidad (lisis) al fago gamma
- ? Detección de anticuerpos (contra Ag capsular o
polisacáridos - de pared celular) por fluorescencia directa
sobre el material - clínico (DFA)
- ? PCR para la toxina de B. anthracis
- ? Inoculación ratón - cobayo (muerte)
41
(No Transcript)
42
Bacillus anthracisFactores de virulencia
- ? Cápsula antifagocítica
- ? Producción de 3 proteínas
- - Antígeno protectivo (PA)
- - Factor letal (LF)
- - Factor edema (EF)
- a) PA LF exotoxina letal
- b) PA EF exotoxina edema
- a) b) inhiben la función de los PMN y la
fagocitosis
43
(No Transcript)
44
Bacillus anthracisInmunización
- 1) Vacunas de células vivas
- - Suspensiones de esporas vivas de cepas no
capsuladas pero productoras de toxina - - No aplicables en humanos
- - Tipos STERNE
- STI (vacuna rusa)
- Pasteur (de virulencia reducida)
- 2) Vacunas acelulares
- - Filtrado (enriquecido en PA) libre de células
de un cultivo de B. anthracis (cepa V770-NP1-R) - toxigénica, no capsulada)
- - Adyuvante sulfato potásico de aluminio
- - AVA (Anthrax vaccine adsorbed) única vacuna
autorizada en USA (Biopart Corporation - Lansing Michigan)
- Efectivas para anthrax cutáneo (93 ) y para
anthrax inhalatorio (estudios en animales) - 3) Vacuna recombinante de PA usada con adyuvante
(Al3, saponina, manofosforil lípido A, Freund,
etc.) - En investigación
45
Profilaxis vacunal preexposicional
- Recomendaciones para su uso
- ? Personal que trabaja en producción de cultivos
de B. anthracis a gran escala o expuestos a - aerosoles
- ? Personal en contacto con productos animales
importados (pelos, lana, pieles, huesos) en
países - en los que las restricciones de importación y
los standares industriales son insuficientes para
- prevenir la exposición a las esporas de B.
anthracis - ? Veterinarios y trabajadores de mataderos en
áreas con alta incidencia de casos de anthrax - ? Población militar de Estados Unidos
- No se recomienda en los siguientes casos
- ? Personal de laboratorio que trabaja con BSL-2
- ? Población civil de países que han sufrido
ataque de bioterrorismo debido a que no puede - predecirse cual será la población target
para el ataque ni puede calcularse el riesgo de - exposición
- ? Profilaxis vacunal post - exposicional
administrada en forma aislada (sin ATB) no es - protectiva
46
Manejo de la situación de exposición a B.
anthracis en correspondencia (CDC)
- 1) Profilaxis ATB (doxycilina ó levofloxacina)
para aquellos potencialmente expuestos - 2) Tomar muestras ambientales
- - Hisopados de superficies (cartas)
- - Hisopados nasales de las personas
potencialmente expuestas (si ? 7 días) - 3) Redefinir la lista de personas potencialmentes
expuestas - - Si no expuestas detener el tratamiento
- - Si expuestas continuar el tratamiento por
un total de 60 días
47
B. anthracisSensibilidad antibiótica
65 cepas de colección del CDC 22 cepas de los
atentados bioterroristas en USA
- ? Número de cepas 87
- ? Método microdilución en caldo
- ? Interpretación NCCLS (puntos de corte para
Staphylococcus spp) - ? Resultados
Quinolonas Rifampicina Tetraciclina Clindamicina C
loranfenicol Aminoglucósidos Vancomicina Imipenem
Meropenem
Macrólidos
I
Cefalosporinas de amplio espectro (CRO) TMS
S
R
2 tipos de ß lactamasa - Penicilinasa (clase A)
inducible - Cefalosporinasa (clase B)
48
AnthraxTratamiento antibiótico
- ? ATB de elección
- - Ciprofloxacina
- - Doxyciclina (no meningitis)
- ? ATB alternativos
- - Penicilina
- - Amoxicilina
- - ß lactamasa inducible puede activarse
durante el tratamiento - - Pobre penetración en macrófagos
- ? Duración del tratamiento 60 días
Niños Embarazo Lactancia
49
AnthraxEpidemiología
- En Estados Unidos
- 18 casos de anthrax inhalatorio (hasta 1976)
- 1 caso de anthrax cutáneo en 1992
- No casos de anthrax entre 1993 - 2000
- - Por ataque bioterrorista (octubre - diciembre
2001 - Anthrax inhalatorio 11 casos confirmados
- Anthrax cutáneo 7 casos confirmados
- 4 casos confirmados
- - Número de muertes 5 (anthrax inhalatorio)
- - Fuentes de las esporas correspondencia
- - Estados afectados Nueva York, Nueva Yersey,
Florida, Connectient y Columbia - En Argentina (Buenos Aires)
- 1977 - 2000 83 casos de anthrax cutáneo
- 2 muertes (hasta 1991 no información oficial
por fallecimiento) - 50 kg de esporas de B. anthracis esparcidos sobre
una población de 500000 habitantes - pueden producir 95000 muertes y 125000
hospitalizaciones
50
B. cereus
51
B. cereusPatologías
- Intoxicación alimentaria
- 2 tipos de síndromes
- a) Diarreico
- - Toxina termolábil (fabricada in vivo)
- - Diarrea 8 - 16 hs después de la ingestión de
alimentos contaminados (carnes, vegetales, - pastas, postres, salsas, leche)
- b) Emético
- - Toxina termoestable (preformada en el alimento)
- - Náuseas y vómitos 1 a 5 horas después de la
ingestión de platos orientales con arroz, - pastas, postres, fórmulas reconstituídas
- - Endoftalmitis postraumática (2 agente
etiológico después de ECN) - - Infecciones en pacientes inmunocomprometidos
bacteriemia, endocarditis, meningitis, - hemorragia cerebral, neumonía, empiemia,
pleuritis, absceso de pulmón, absceso - cerebral, osteomielitis, salpingitis e
infecciones cutáneas primarias - - Infección de heridas postquirúrgicas,
post-accidentes de tránsito, fijación de yesos y - quemaduras
52
Bacillus sppFactores predisponentes para la
bacteriemia
- ? Neoplasias
- ? Drogadicción EV
- ? Hemodiálisis
- ? Cateterización
- ? Diabetes
- ? Trauma
- ? Neutropenia
53
Bacillus spp y Neoplasia
- ? Bebe y Koneman, Clin. Microbiol. Rev. 1995
- ? 140 pacientes con bacteriemia 63 (45 ) con
algún tipo de neoplasia (leucemia, linfoma,
mieloma múltiple y carcinoma - ? Especies más frecuentes. B. cereus y B.
subtilis - ? Mayor condición predisponentes la neutropenia
- ? Puerta de entrada más frecuente uso de
catéteres EV - ? La mayoría de los pacientes hospitalizados
54
Bacilos gram positivos esporulados cuando
jerarquizarlos y otras consideraciones
- ? Cuando se los aisla en cultivo puro o como
flora predominante en muestras con bacterioscopía
- ? Cuando el aislamiento proviene de un material
noble (sangre, LCR) - ? Cuando el aislamiento es relevante desde el
punto de vista clínico - ? Cuando se repite el aislamiento en un 2
especimen clínico - ? La infección ocular por B. cereus constituye
siempre una emergencia - ? El desarrollo moderado o abundante de B. cereus
en una herida se considera - usualmente significativo según algunos autores
(Barnham y col.) - ? Bacillus cereus es considerado el agente
etiológico de una intoxicación - alimentaria si se lo aisla simultáneamente del
alimento (gt 105 UFC/g) y de las - heces o vómitos del paciente y la cepa es
enterotoxina
55
Conclusión
- Debemos estar alerta frente al aislamiento de
- un bacilo gram positivo aerobio, esporulado,
- inmóvil, no beta-hemolítico y lecitinasa positiva
- de muestras clínicas o ambientales