D - PowerPoint PPT Presentation
1 / 49
Title:
D
Description:
lorsque CD4 350/mm3 : risques plus faibles d' chec virologique et de ... Tous bras/doses de raltegravir confondus. Etude MERIT : maraviroc chez des patients na fs ... – PowerPoint PPT presentation
Number of Views:52
Avg rating:3.0/5.0
Title: D
1
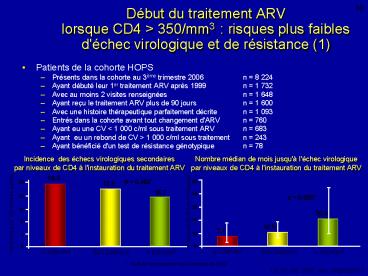
Début du traitement ARV lorsque CD4 gt 350/mm3
risques plus faibles d'échec virologique et de
résistance (1)
10
- Patients de la cohorte HOPS
- Présents dans la cohorte au 3ème trimestre 2006
n 8 224 - Ayant débuté leur 1er traitement ARV après 1999
n 1 732 - Avec au moins 2 visites renseignées n 1 648
- Ayant reçu le traitement ARV plus de 90 jours n
1 600 - Avec une histoire thérapeutique parfaitement
décrite n 1 093 - Entrés dans la cohorte avant tout changement
d'ARV n 760 - Ayant eu une CV lt 1 000 c/ml sous traitement ARV
n 683 - Ayant eu un rebond de CV gt 1 000 c/ml sous
traitement n 243 - Ayant bénéficié d'un test de résistance
génotypique n 78
Incidence des échecs virologiques
secondaires par niveaux de CD4 à l'instauration
du traitement ARV
Nombre médian de mois jusqu'à l'échec
virologique par niveaux de CD4 à l'instauration
du traitement ARV
Mois jusqu'à l'échec virologique
Test de comparaison des 3 strates de CD4
Uy JP, IAS 2007, Abs. WEPEB017
2
Début du traitement ARV lorsque CD4 gt 350/mm3
risques plus faibles d'échec virologique et de
résistance (2)
11
Prévalence des mutations de résistance au moment
du rebond virologique après un premier succès
virologique, par niveau de CD4 à l'instauration
du traitement ARV (n 78)
Uy JP, IAS 2007, Abs. WEPEB017
3
Le risque d'événements cliniques majeurs n'est
pas négligeable chez les patients non-traités,
même si CD4 gt 250/mm3 SMART encore ! (1)
12
- Sélection des patients
- Patients inclus dans lessai SMART (traitement
continu vs intermittent) - Naïfs d'ARV ou sans traitement ARV à la
randomisation - CV gt 10 000 c/ml avant randomisation
- Critères de jugement
- Maladie opportuniste ou décès (critère principal
SMART) - Maladie opportuniste (fatale ou non)
- Événement non-SIDA grave
- Critère composite 2 ou 3
Maladie opportuniste ou décès
- ARV immédiat début des ARV après inclusion dans
lessai - ARV différé début des ARV uniquement lorsque
CD4 lt 250
Emery S, IAS 2007, Abs. WEPEB018
4
Le risque d'événements cliniques majeurs n'est
pas négligeable chez les patients non-traités,
même si CD4 gt 250/mm3 SMART encore ! (2)
13
Événements cliniques (critère composite) selon
le bras de traitement et la dernière valeur de CD4
Dernière valeur de CD4 (/mm3) ARV différé ARV différé ARV différé ARV immédiat ARV immédiat ARV immédiat
Dernière valeur de CD4 (/mm3) Années-pt () a Evénements b Taux c Années-pt () a Evénements b Taux c
lt 250 19 (6,4) 3 (2) 16,0 10 (2,6) 1 10,4
250-349 65 (21,7) 6 (3) 9,2 30 (7,9) 2 6,7
350-499 118 (39,5) 9 (7) 7,6 109 (28,8) 2 1,8
gt 500 97 (32,4) 3 (2) 3,1 230 (60,7) 0 0
a Temps passé dans la catégorie de CD4, censuré à
la survenue de l'événement b 1er événement
seulement le chiffre entre parenthèses est le
nombre d'événements survenus avant la reprise du
traitement C Pour 100 années-patient
Emery S, IAS 2007, Abs. WEPEB018
5
Un essai évaluant l'intérêt d'un traitement
antirétroviral précoce, maintenant ! (1)
14
Proposition d'essai du groupe INSIGHT essai
START Strategic Timing of Antiretroviral Treatment
Patients infectés par le VIH, lymphocytes CD4 gt
500 /mm3
Bras "précoce" Début ARV immédiat n 600 pour
la première phase n ? 1 500 pour l'essai entier
Bras différé Début ARV quand CD4lt 350/mm3 ou si
symptômes n 600 pour la première phase n ? 1
500 pour l'essai entier
Gordin F, IAS 2007, Abs. MOSY205
6
Lespérance de vie des patients VIH après
séroconversion continue à saméliorer
16
- CASCADE (23 cohortes européennes)
- 15 768 patients à date de contamination VIH
connue entre 1980 et 2006 - Age médian lors de la contamination 29 ans (IQR
24-36)
RR (IC 95 ) de décès après séroconversion VIH
Estimation de la probabilité de survie après
séroconversion VIH selon lâge au moment de la
séroconversion (exclusion des patients
diagnostiqués après 1/1/2004)
Année de séroconversion Versus période pré-HAART
1996 0,79 (0,70-0,90)
1998-1999 0,21 (0,18-0,24)
2000-2001 0,16 (0,13-0,18)
2002-2003 0,14 (0,11-0,16)
2004 0,09 (0,05-0,14)
2005-2006 0,14 (0,08-0,24)
15-24 ans 25-34 ans 35-44 ans gt 45 ans
Survie à 10 ans 94,4 97,7 96 87,9
Survie à 15 ans 91,4 91,4 89,7 73,2
- Chez les patients âgés de moins de 45 ans,
lespérance de vie 10 ans après la
séroconversion est moins bonne chez les
toxicomanes (92 ) que chez les homosexuels
masculins (97 ) et les hétérosexuels (96 ) p lt
0,001
Porter K, IAS 2007, Abs. TUPEB093
7
Traitements antirétroviraux
- Patients naïfs
8
Essai DART (ZDV/3TC/NVP versus ZDV/3TC/ABC)
discordance entre la réponse immuno-virologique
et lévolution clinique à S48
44
Munderi P, IAS 2007, Abs. WEAB1LB
9
Etude ALERT TVD (ATV/r versus fAPV/r) qd en
traitement de 1ère ligne - Résultats à S48
45
- 106 patients naïfs, ARN VIH 1 000 c/ml (médiane
4,9 log10 c/ml), CD4 190/mm3 (moyenne) - Etude randomisée, ouverte, 2 bras
- TDF/FTC fAPV/r 1 400/100 mg qd
- TDF/FTC ATV/r 300/100 mg qd
fAPV/r J0/S48 ATV/r J0/S48
Cholestérol total (mg/dl) 160/171 153/180
Triglycérides (mg/dl) 116/150 124/131
HDL-cholestérol (mg/dl) 38/43 37/48
LDL-cholestérol (mg/dl) 95/99 97/101
Hyperbilirubinémiegrade 2-4 0 13
Diarrhée grade 2-4 8 4
Clairance créatinine (MDRD) moyenne ml/min/1,73 m² 4 - 3,5
CV lt 50 c/ml à S48 (ITT, MD E)
Smith K, IAS 2007, Abs. WEPEB023
10
Etude IMANI-2 monothérapie par LPV/r chez des
patients naïfs - Résultats à S48 (1)
48
- Etude pilote, 39 patients naïfs dARV, sans
mutation de résistance IP ni M184V, monothérapie
par LPV/r 400/100 mg bid SGC puis comprimés - CV médiane inclusion 4,48 log10 c/ml CV gt 5
log10 c/ml 26 - CD4 médiane inclusion 258/mm3 CD4 lt 200/mm3
34 - Critère principal CV lt 75 c/ml (bDNA) à S48
- Gain médian de CD4 à S24 178/mm3, à S48
234/mm3 - Aucun arrêt de traitement jusquà S48
Gathe Jr JC, IAS 2007, Abs. WEPEB034
11
Etude IMANI-2 monothérapie par LPV/r chez des
patients naïfs - Résultats à S48 (2)
49
- 6 échecs virologiques
- 5 avec observance imparfaite, 1 prétraité inclus
à tort - 2 patients avec sur le génotype présence de
nouvelles mutations sur la protéase mais
phénotype sensible - Parmi les 5 patients en rebond modéré (CV entre
75 et 400 c/ml) avec observance imparfaite, 4/5
récupèrent une CV indétectable après counseling
sur observance et intensification - 3 LPV/r 600/150 mg bid, 2 ajouts de TDF/3TC
Modifications lipidiques
Médiane, mg/dl J0 S48 Variation ()
Cholestérol total 163 210 29
HDL-cholestérol 39 51 24
Non HDL-cholestérol 124 159 29
Triglycérides 116 215 45
Gathe Jr JC, IAS 2007, Abs. WEPEB034
12
Etude KALEAD-1 LPV/r 2 INTIs versusLPV/r
TDF en traitement de 1ère ligne
50
- Etude randomisée, ouverte, 152 patients naïfs
dARV - LPV/r SGC TDF versus LPV/r SGC 2 INTIs
choisis par investigateur (ZDV/3TC 64 ,
ABC/3TC 26 , pas d'association comportant TDF)
LPV/r TDF n 72 LPV/r 2 INTIs n 80
Moyenne CV J0 (log10 c/ml) 4,81 4,92
Médiane CD4 J0 (/mm3) 231 199 (p 0,02)
CV lt 50 c/ml à S48 (ITT) 50 54
CV lt 50 c/ml à S48 (OT) 92 93
Rebond virologique 5 (7 ) 3 (4 )
EI tous grades 53 65
Dyslipidémie 14 25 (p 0,086)
- Réponse CD4 significativement plus importante
dans le groupe TDF - Pas de différence dans lincidence des EIs sauf
pour la dyslipidémie
Pinola M, IAS 2007, Abs. WEPEB035
13
Etude MK-0518/004 raltegravir chez les
patients naïfs - résultats à S48 (1)
51
- Essai international (hors Europe), phase IIb,
randomisé - Patients naïfs dARV (CV 5 000 c/ml, CD4 gt
100/mm3) - 5 groupes de traitement TDF/3TC RGV 4 doses
différentes vs EFV
CV lt 400 c/mlITT, NC E
CV lt 50 c/mlITT, NC E
RGV 100 mg bid (n 39)
RGV 400 mg bid (n 41)
EFV 600 mg qd (n 38)
RGV 200 mg bid (n 40)
RGV 600 mg bid (n 40)
Markowitz M, IAS 2007, Abs. TUAB104
14
52
Etude MK-0518/004 raltegravir chez les
patients naïfs - résultats à S48 (2)
Modifications des paramètres lipidiques (mg/dl) à
S48 par rapport à J0
Raltegravir Raltegravir Efavirenz Efavirenz RGV versus EFV
Moyenne à J0 Modif. moyenne Moyenne à J0 Modif. moyenne RGV versus EFV
Cholestérol 165,9 -2,3 168,7 20,7 p lt 0,001
LDL-cholestérol 103,8 -7,5 108,9 3,0 p 0,016
Triglycérides 131,8 -1,0 127,3 49,5 p 0,068
Cholestérol total/HDL-cholestérol 4,59 -0,59 4,72 -0,47 p 0,52
Tous bras/doses de raltegravir confondus
Markowitz M, IAS 2007, Abs. TUAB104
15
Etude MERIT maraviroc chez des patients naïfs
Résultats à S48 (1)
53
Combivir (ZDV 3TC) Efavirenz
Randomisation11
Combivir (ZDV 3TC) Maraviroc (MVC) 300 mg
bid
6 semaines
J0
Screening
S96
S48
1er patient novembre 2004
Analyse principale
- Critères inclusion
- patients naïfs dARV, âge gt 16 ans
- ARN VIH-1 gt 2 000 c/ml, pas de résistance à ZDV,
3TC, EFV - tropisme R5 (Trofile Monogram)
- Stratification sur
- ARN VIH-1 lt ou gt 100 000 c/ml au screening
- zone géographique Hémisphère Nord ou Hémisphère
Sud
En cas de toxicité liée à ZDV ou 3TC,
substitution possible avec autres INTI Le 3ème
bras de létude (MVC 300 mg qd) a été arrêté
prématurément (205 patients ayant atteint S16)
pour efficacité insuffisante
Saag M, IAS 2007, Abs. WESS104
16
Etude MERIT maraviroc chez des patients naïfs
Résultats à S48 (2)
54
Données à linclusion et causes darrêt au cours
des 48 semaines
Patients randomisés n 740Traités n 721 CBV EFV n 361 CBV MVCn 360
Hommes 72 71
Race, n () Blanche Noire 198 (54,8)133 (36,8) 204 (56,7)123 (34,2)
Médiane CD4 (extrêmes), /mm3 254 (8-1053) 241(5-1422)
ARN VIH-1 moyen (DS), log10 c/ml 4,88 (0,699) 4,86 (0,640)
Causes darrêt Causes darrêt Causes darrêt
N Total () 91 (25,2) 97 (26,9)
Effets indésirables 49 (13,6) 15 (4,2)
Défaut defficacité 15 (4,2) 43 (11,9)
Autres raisons 9 (2,5) 14 (3,9)
Retrait de consentement ou perdus de vue 18 (5,0) 25 (6,9)
Saag M, IAS 2007, Abs. WESS104
17
Etude MERIT maraviroc chez des patients naïfs
Résultats à S48 (3)
55
de patients avec CV indétectable par visite
CV lt 400 c/ml
CV lt 50 c/ml
CBV EFV (n 361)
Valeur manquante échec/non réponse
Saag M, IAS 2007, Abs. WESS104
18
Etude MERIT maraviroc chez des patients naïfs
Résultats à S48 (4)
56
de patients avec CV indétectable à S48 (analyse
en ITT)
Différence ajustée sur les strates de
randomisation
Borne inférieure de lIC 97,5 Limite de
non infériorité -10
- Analyse per protocole
- CV lt 400 c/ml différence -4,1 (-10,5)
- CV lt 50 c/ml différence -4,4 (-11,2)
Saag M, IAS 2007, Abs. WESS104
19
Etude MERIT maraviroc chez des patients naïfs
Résultats à S48 (5)
57
Évolution moyenne des CD4 (/mm3) à S48 (analyse
LOCF)
Différence ajustée sur les strates de
randomisation
Saag M, IAS 2007, Abs. WESS104
20
Etude MERIT maraviroc chez des patients naïfs
Résultats à S48 (6)
58
des patients avec CV lt 50 c/ml à S48
CBV EFV
CBV MVC
Valeur manquante échec/non réponse
Hémisphère Nord centres investigateurs Amérique
du Nord et Europe Hémisphère Sud centres
investigateurs Argentine, Afrique du Sud et
Australie
Saag M, IAS 2007, Abs. WESS104
21
Etude MERIT maraviroc chez des patients naïfs
Résultats à S48 (7)
59
Événements cliniques (données au 21 juin 2007)
Événements, n () CBV EFV n 361 CBV MVC n 360
Événements indésirables
Grade 3 66 (18,3) 51 (14,2)
Grade 4 24 (6,6) 22 (6,1)
EIG 46 (12,7) 41 (11,3)
Événements classant SIDA 12 (3,3) 6 (1,7)
Infections 8 (2,2) 5 (1,4)
Tuberculose 8 1
Herpes simplex 1 1
Pneumonie 0 2
Pneumocystose 0 1
Néoplasies SIDA 4 (1,1) 1 (0,3)
Maladie de Hodgkin 2 0
LMNH 1 1
Kaposi 1 0
Affections malignes (total) 16 (4,4) 10 (2,8)
Décès 1 1
Saag M, IAS 2007, Abs. WESS104
22
Etude MERIT maraviroc chez des patients naïfs
Résultats à S48 (8)
60
Perturbations biologiques hépatiques (sans
ajustement sur la durée dexposition)
Variations maximales (g/l) médianes des lipides à
jeun
CBV EFV CBV MVC
AST Grade 3 (5-10 N) Grade 4 (gt10 N) 9/350 (2,6 )2/350 (0,6 ) 7/353 (2,0 )5/353 (1,4 )
ALT Grade 3 (5-10 N) Grade 4 (gt 10 N) 9/350 (2,6 )2/350 (0,6 ) 9/353 (2,5 )2/353 (0,6 )
Bilirubine totale Grade 3 (2,5-5 N) Grade 4 (gt 5) 0/3450/345 3/352 (0,9 )0/352
Ces 3 patients ont eu une hyperbilirubinémie
non associée à une élévation des transaminases,
liée dans 2 cas à une maladie de Gilbert
Saag M, IAS 2007, Abs. WESS104
23
Etude MERIT maraviroc chez des patients naïfs
Résultats à S48 (9)
61
Résumé
- Le darrêts est similaire (MVC 26,9 versus
EFV 25,2 ) mais - le taux darrêt dû à un manque defficacité est
plus élevé dans le bras MVC (11,9 versus 4,2 ) - le taux darrêt dû à des effets indésirables est
moins élevé dans le bras MVC (4,2 versus 13,8
) - En se basant sur lanalyse statistique prévue
(limite de non infériorité de lIC 97,5 de la
différence à -10 ) le MVC a été - non inférieur à lEFV au seuil de CV de 400 c/ml
70,6 versus 73,1 - mais pas non inférieur au seuil de CV de 50 c/ml
65,3 versus 69,3 - Laugmentation des CD4 a été plus élevée dans le
bras MVC (170 versus 144/mm3) - Peu dévénements indésirables de grade 3 et 4
dans les 2 bras - Moins dévénements classant SIDA dans le bras MVC
(n 6 versus n 12) - Incidence des affections malignes moins élevée
dans le bras MVC
Saag M, IAS 2007, Abs. WESS104
24
Traitements antirétroviraux
- Patients prétraités en succès
25
Etude BICOMBO switch dINTI chez des patients
virologiquement contrôlés Kivexa versus
Truvada (1)
62
- 335 patients sous HAART contenant 3TC avec CV lt
200 c/ml 6 mois - Randomisation 11 stratifiée sur INNTI et IP dans
le schéma en cours changement des INTIs pour
KVX ou TVD - Evaluation à S48
- Critère principal échec (rebond CV gt 200 c/ml,
arrêt de traitement, perdu de vue, événement
SIDA, décès) - KVX 19 vs TVD 13 (IC 95 de la ? -2,0
14) ? non-infériorité non démontrée - Critère secondaire échec virologique (rebond CV
gt 200 c/ml) - KVX 2,4 vs TVD 0 (IC 95 de la ? 0,05
6,0) ? non-inférioritéde KVX - Les 4 échecs virologiques sont tous survenus sous
KVX ( NVP ou EFV) - Evolution médiane CD4 KVX 44/mm3 vs TVD
-3/mm3 - 9 HSR dans groupe KVX, et 2 cas de toxicité
rénale dans groupe TVD - Modification TG, cholestérol total et
LDL-cholestérol significativement en faveur de
TVD, modification HDL-cholestérol en faveur de
KVX - Evolution médiane clairance créatinine
- KVX 1,3 ml/min/1,73m2 vs TVD -0,5
ml/min/1,73m2
Martinez E, IAS 2007, Abs. WESS102
26
Etude BICOMBO switch dINTI chez des patients
virologiquement contrôlés Kivexa versus
Truvada (2)
63
KIVEXA (n 167) TRUVADA (n 166)
Arrêt traitement 29 (17 ) 22 (13 )
pour EI 17 (10 ) 9 (5 )
pour décès 0 1 (hémorragie cérébrale)
pour échec virologique 2 0
pour perte de vue 5 8
pour décision patient 4 2
pour autre raison 1 2
- Importantes limites méthodologiques
- 7 des patients du groupe KVX étaient déjà sous
ABC et 34 des patients du groupe TVD étaient
déjà sous TDF au moment de lentrée dans létude - Test HLA B57 non réalisé avant la randomisation,
la différence dans le taux déchec (supérieur
pour le groupe KVX) étant essentiellement
expliquée par les HSR à lABC
Martinez E, IAS 2007, Abs. WESS102
27
Traitements antirétroviraux
- Patients prétraités en échec
28
Etude TITAN DRV/r versus LPV/r chez des
patients prétraités, naïfs de LPV/rRésultats à
S48 (3)
67
CV lt 400 c/ml à S48 (ITT, TLOVR)
CV lt 50 c/ml à S48 (ITT, TLOVR)
??médian CD4 à S48 (ITT, NCE)
Lestimation de la différence entre les 2 bras
prend en compte le traitement reçu et les
facteurs de stratification (CV inclusion et INNTI
dans TO)
Valdez-Madruga J, IAS 2007, Abs. TUAB101
29
Etude TITAN DRV/r versus LPV/r chez des
patients prétraités, naïfs de LPV/rRésultats à
S48 (4)
68
Fréquence des effets indésirables
Disposition des patients
Incidence () DRV/r LPV/r
Randomisé traité/non traité 298/302 297/302
Interruption traitement 62 (20,8 ) 86 (29,0 )
EI/événement VIH 20 (6,7 ) 21 (7,1 )
Perdu de vue 10 (3,4 ) 10 (3,4 )
Retrait consentement 9 (3,0 ) 10 (3,4 )
Echec virologique 4 (1,3 ) 34 (11,4 )
Non adhérence 11 (3,7 ) 4 (1,3 )
Autre 8 (2,7 ) 7 (2,4 )
Valdez-Madruga J, IAS 2007, Abs. TUAB101
30
Etude TITAN DRV/r versus LPV/r chez des
patients prétraités, naïfs de LPV/rRésultats à
S48 (5)
69
Anomalies biologiques de grade 2-4
DRV/r (n 298) LPV/r (n 297)
ALAT 26 (8,7 ) 26 (8,8 )
ASAT 20 (6,7 ) 26 (8,8 )
Cholestérol total 94 (31,5 ) 86 (29 )
LDL-cholestérol 56 (18,8 ) 50 (16,8 )
Triglycérides 57 (19,1 ) 75 (25,3 )
Hyperglycémie 26 (8,7 ) 28 (9,4 )
Amylase pancréatique 33 (11,1 ) 26 (8,8 )
Lipase 14 (4,7 ) 11 (3,7 )
Valdez-Madruga J, IAS 2007, Abs. TUAB101
31
Etude TITAN DRV/r versus LPV/r chez des
patients prétraités, naïfs de LPV/rRésultats à
S48 (6)
70
- Points à prendre en considération
- Grande hétérogénéité des patients inclus
- 23 en interruption thérapeutique depuis plus de
1 mois - 31 naïfs dIP, 31 ayant reçu 2 IPs
(essentiellement des IPs non boostés) - 24 naïfs dINNTI
- Traitement optimisé déséquilibré
- patients recevant 2 INTIs actifs DRV/r 65
versus LPV/r 51 - patients recevant 0 INTI actif DRV/r 10
versus LPV/r 15 - Les patients avec virus résistants au LPV/r
nétaient pas exclus - avec résistance phénotypique 10 FC au LPV/r
12 - Utilisation des capsules molles (et non des
comprimés) de LPV/r - Conclusions
- La supériorité (statistique) du DRV/r est en
grande partie expliquée par linclusion de
patients R au LPV/r et par le traitement optimisé
moins fréquemment optimal dans le groupe LPV/r - Chez les patients sensibles au LPV/r, les 2 IPs
sont équivalents - Tolérance clinique et biologique globalement
équivalente entre DRV/r et LPV/r, mais - Plus de diarrhée avec LPV/r, 2 fois plus de rash
avec DRV/r
Valdez-Madruga J, IAS 2007, Abs. TUAB101
32
Etudes DUET-1 et DUET-2 etravirine (ETV)
versus placebo chez des patients prétraités
74
48 semaines de traitement avec 48 semaines
dextension optionnelle
Analyse principale S24
ETV TO (n 300 par étude)
600 patients dans chaque étude
Randomisation 11
Placebo TO (n 300 par étude)
TO DRV/r INTIs optimisés ENF
- Critères de sélection
- CV gt 5 000 c/ml
- Traitement ARV stable 8 semaines, non modifié
jusquà J0 - 3 mutations primaires IP à la visite de
sélection - 1 mutation INNTI à la visite de sélection ou
sur génotype antérieur - Critère de jugement principal CV lt 50 c/ml
lorsque tous les patients ont - atteints S24 ou arrêté létude
Mills A, IAS 2007, Abs. WESS204-1 Katlama C,
IAS 2007, Abs. WESS204-2
33
Etudes DUET-1 et DUET-2 caractéristiques des
patients et données à linclusion
75
DUET-1 DUET-1 DUET-2 DUET-2
ETV TO(n 304) Placebo TO(n 308) ETV TO(n 295) Placebo TO(n 296)
Homme 87 86 94 92
Caucasien 65 65 77 76
CV médiane (log10 c/ml) 4,8 (2,7-6,2) 4,9 (2,4-6,5) 4,8 (3,0-6,8) 4,8 (2,2-6,3)
CD4 médiane (/mm3) 99 (1-789) 109 (1-694) 100 (1-708) 108 (0-912)
ATCD 1015 ARVs 67 65 62 67
Antécédent traitement par darunavir/r 5 5 3 5
2 mutations de R à INNTI 66 67 65 65
4 mutations primaires IP 60 59 65 66
Utilisation ENF (total) 40 41 52 53
Utilisation ENF de novo 24 26 27 27
Score de sensibilité phénotypique 0 15 15 16 16
Score de sensibilité phénotypique 1 35 31 35 42
Mills A, IAS 2007, Abs. WESS204-1 Katlama C,
IAS 2007, Abs. WESS204-2
34
Etudes DUET-1 et DUET-2 CV lt 50 c/ml à S 24
(ITT-TLOVR)
76
Critère de jugement principal
DUET-1
DUET-2
Mills A, IAS 2007, Abs. WESS204-1 Katlama C,
IAS 2007, Abs. WESS204-2
35
Etudes DUET-1 et DUET-2 réponse virologique
(CV lt 50 c/ml) à S24 selon le nombre de
molécules actives du TO
77
DUET-1
DUET-2
SSP Score de Sensibilité Phénotypique. Le
darunavir et lenfuvirtide étaient comptées comme
des molécules actives si FC lt 10 ou utilisé de
novo, respectivement
Mills A, IAS 2007, Abs. WESS204-1 Katlama C,
IAS 2007, Abs. WESS204-2
36
Etudes DUET-1 et DUET-2 résultats de tolérance
78
ETV (n 599) Placebo (n 604)
EI grade 3/4 8 9
EIG 13,5 18,5
Arrêt pour EI 5,5 4,5
Décès 1,3 2,5
Rash 17 9
Nausées 14 11
Diarrhée 15 20
Céphalées 10 12
Troubles SNC 15 19
Troubles psychiatriques 13 16
EI hépatique 5 5,5
Faible incidence des anomalies lipidiques (3 à 7
) et hépatiques biologiques (1 à 3 ) de grade
3-4, et non différente entre les 2 groupes
Mills A, IAS 2007, Abs. WESS204-1 Katlama C,
IAS 2007, Abs. WESS204-2
37
Etudes MOTIVATE 1 et 2 maraviroc chez les
patients prétraités avec VIH à tropisme R5 (1)
82
TO maraviroc (150 mg qd)
MOTIVATE 1 (n 601) MOTIVATE 2 (n 475)
TO maraviroc (150 mg bid)
TO placebo
S48
S24 Analyse intermédiaire planifiée
- Critères dinclusion
- ARN VIH gt 5 000 c/ml
- Virus CCR5 et absence de mise en évidence de
virus CXCR4 - gt 6 mois de traitement ET/OU résistance à au
moins une molécule de 3 classes dARV ( 2 pour
les IP) - Randomisation 221, stratifiée sur CV et
utilisation denfuvirtide - Etude de supériorité, puissance gt 98 de
détecter différence CV de 0,5 log10 c/ml
TO 3 à 6 ARV (RTV booster non considéré comme
ARV) MVC 150 mg si association à IP/r (sauf
TPV/r) ou delavirdine 300 mg dans les autres cas
Nelson M, CROI 2007, Abs. 104aLB Lalezari J,
CROI 2007, Abs. 104bLB
38
Etudes MOTIVATE 1 et 2 (MVC chez prétraités)
résultats combinés à S24 (4)
88
CV lt 50 c/ml selon les CD4 initiaux (moyenne
screening et J0)
Gulick R, IAS 2007, Abs. WEPEB116LB
39
Essai ACTG 5211 phase II du vicriviroc chez des
patients en échec virologique - Résultats à S48
(1)
89
- Essai randomisé à 4 bras (VCV 5 mg arrêté pour
inefficacité) - 118 adultes pré-traités par ARV
- CV 5 000 c/ml sous ARV
- Phénotype R5 au screening
- Ritonavir 100 mg/j dans tous les schémas de
traitement - Critère de jugement échec virologique défini
par une baisse de CV lt 1 log10 c/ml après 16
semaines de traitement
Gulick R, IAS 2007, Abs. TUAB102
40
90
Essai ACTG 5211 phase II du vicriviroc chez des
patients en échec virologique - Résultats à S48
(2)
CV lt 50 c/ml
- Échec virologique
- Placebo 86
- VCV 10 mg 27
- VCV 15 mg 33
Gulick R, IAS 2007, Abs. TUAB102
41
91
Essai ACTG 5211 phase II du vicriviroc chez des
patients en échec virologique - Résultats à S48
(3)
Échecs virologiques selon le tropisme à J0
Effets indésirables
- EI grade 3-4
- Pas de différence entre les 4 bras
- Cancers
- 8 sujets des bras VCV
- 2 LMNH, 2 Hodgkin
- 1 adénocarcinome gastrique
- 2 cancers cutanés (1 EOAS, 1 EOAB)
- 1 rechute de Kaposi
- 2 sujets du bras PCB
- 2 EOAB (1 sujet ayant reçu VCV pendant 3 mois)
Screening tropisme R5 chez les 118 pts J0
tropisme R5, n 102 (86 ) tropisme
dual/mixte, n 12 (10 ) données manquantes, n
4 (4 )
Gulick R, IAS 2007, Abs. TUAB102
42
Complications
43
Etude PREDICT-1 évaluation de lutilité
clinique du test HLA-B5701 pour réduire
lincidence de lHSR à labacavir (2)
102
Valeur prédictive négative du screening
HLA-B5701 - pour HSR cliniquement suspectée
96 - pour HSR immunologiquement confirmée
100
Vigilance clinique vis à vis du risque dHSR
reste de mise pour toute mise sous ABC
Mallal S, IAS 2007, Abs. WESS101
44
Arrêt névirapine pour rash ou toxicité hépatique
cohorte ATHENA (2)
106
RR ajusté sur sexe et origine géographique
HH CD4 hauts au nadir, hauts à J0 BH CD4 bas
au nadir, hauts à J0 BB CD4 bas au nadir, bas à
J0
Nadir introduction ARV J0 introduction
névirapine
- Conclusions
- Les patients prétraités avec un nadir de CD4 bas
et un taux actuel de CD4 élevé et une CV
indétectable ont un risque darrêt de NVP pour
intolérance similaire à celui des patients naïfs
à CD4 bas - Chez les patients prétraités débutant NVP avec CV
détectable, les femmes et particulièrement celles
dorigine asiatique ont un risque accru
dintolérance à la NVP
Wit F, IAS 2007, Abs. MOPEB008
45
Insuffisance rénale prévalence et facteursde
risque (cohorte Aquitaine-ANRS) (2)
108
Analyse multivariée facteurs associés à la
présence dune insuffisance rénale
Variables Variables RR (IC 95 ) p
Ref homme Femme 3,22 (2,52-4,12) lt 10-4
Age (ref lt 41 ans) 41-50 gt 50 2,47 (1,87-3,24) 13,32 (9,8-18,1) lt 10-4 lt 10-4
IMC (kg/m²) (ref gt 22) lt 22 3,84 (3,01-4,90) lt 10-4
Stade infection VIH Sida 1,32 (1,02-1,70) 0,0334
Charge virale (c/ml) (ref gt 10 000) lt 50 50-10 000 1,57 (1,17-2,10) 1,21 (0,88-1,67) 0,0025 NS
Exposition au TDF (années) lt 1 1 1,19 (0,84-1,68) 1,62 (1,20-2,19) NS 0,0016
- Autres variables ne ressortant pas dans lanalyse
multivariée durée infection VIH, durée
exposition INTI, INNTI, IP, diabète, HTA,
hyperlipidémie - Limites de létude pas de suivi longitudinal,
non prise en compte des séquences de traitement
ARV ni des associations dARV, regroupement des
IR légères (qui représentent 78 des cas),
modérées et sévères, définition de linsuffisance
rénale sur la seule formule de Cockroft-Gault (vs
MDRD)
Morlat P, IAS 2007, Abs. MOPEB066
46
QuantiFERON-TB GOLD (QTB) pour le diagnostic de
tuberculose active chez des patients infectés par
le VIH
115
- Étude prospective longitudinale en Autriche
(faible prévalence de la tuberculose) - Bilan BK trimestriel chez 769 patients infectés
par le VIH - Bilan diagnostique exhaustif si QTB
- Conclusion la sensibilité du QTB est de 100
pour le diagnostic de tuberculose active des
patients VIH en zone de faible prévalence
Aichelburg MC, IAS 2007, Abs. MOPEB021
47
Test Elispot-IF-? TB pour le diagnostic de
tuberculose active chez des enfants infectés par
le VIH
116
- Enfants infectés par le VIH, en Afrique du Sud
- Évaluation diagnostique de lElispot en cas de
suspicion de tuberculose - Classification OMS (TB certaine, possible ou
exclue) - Comparaison test intradermique versus test
Elispot-TB
Sensibilité Sensibilité Sensibilité Sensibilité Sensibilité Sensibilité
Diagnostic de TBcertaine probable IDR Sensibilité IDR (IC 95 ) Elispot Sensibilité Elispot (IC 95 ) p
Diagnostic de TBcertaine probable 10/32 31 (14-48) 27/38 71 (56-86) 0,0008
Spécificité Spécificité Spécificité Spécificité Spécificité Spécificité
Diagnostic de TB exclue IDR Spécificité IDR (IC 95 ) Elispot Spécificité Elispot (IC 95 ) p
Diagnostic de TB exclue 38/45 84 (73-95) 55/77 71 (61-82) 0,104
Davies MA, IAS 2007, Abs. MOPEB022
48
Étude SMART maladies opportunistes et mortalité
chez les patients co-infectés par le VHB et/ou
le VHC (1)
121
- Dans létude SMART les patients dans le bras
traitement discontinu avaient un risque majoré
(hazard ratio 2,6) de maladie opportuniste (MO)
ou de décès (toutes causes) - Cette sous-étude sintéresse aux 922 patients
co-infectés qui constituent 16,8 des patients
inclus (VHB 2 VHC 14,6 VHB/VHC
0,2 ) mais qui représentent 47 des décès non
liés à une maladie opportuniste (MO)
Hazard ratio (co-infectés par rapport à non
co-infectés) IC 95
Tedaldi E, IAS 2007, Abs. TUAB203
49
Étude SMART maladies opportunistes et mortalité
chez les patients co-infectés par le VHB et/ou
le VHC (2)
122
- Causes des 37 décès non liés à une maladie
opportuniste, chez les patients co-infectés VHB
et/ou VHC
Tedaldi E, IAS 2007, Abs. TUAB203