DIAGRAM METODA KROMATOGRAFI - PowerPoint PPT Presentation
Title:
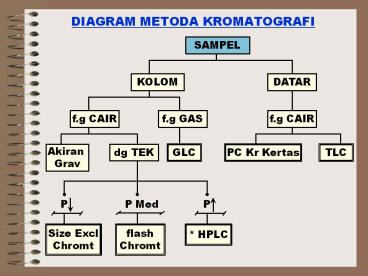
DIAGRAM METODA KROMATOGRAFI
Description:
DIAGRAM METODA KROMATOGRAFI SAMPEL KOLOM DATAR f.g CAIR f.g GAS f.g CAIR Akiran Grav dg TEK GLC PC Kr Kertas TLC P Med P P Size Excl Chromt flash Chromt * HPLC Teknik ... – PowerPoint PPT presentation
Number of Views:1967
Avg rating:3.0/5.0
Title: DIAGRAM METODA KROMATOGRAFI
1
DIAGRAM METODA KROMATOGRAFI
2
Group Ion Excl HPCL Basa Kuat CH2N(CH3)3,Cl- Med
Basa N(CH3)3,Cl- Basa Lmh NH(R)2,Cl- Asam Kuat
SO3-,H Med Asam HPO3-,Na
Excl Chromt ? LC berdasar pemisahan/per perbedaan
dimensi molekul. Contoh kompl camp protein dan
estrogen ? BM beda,? dpt dipisahkan dg
Chromatografi
3
KROMATOGRAFI
- salah satu cara pemisahan dengan
- dasar analisis menggunakan
Pemisahan tergantung pada gerakan relatif dua
fasa tersebut. Dari sifat-sifat kedua fasa ?
Kromatografi dapat digolongkan
4
(No Transcript)
5
Dari 4 macam bentuk fasa yang dapat digunakan
untuk an. Kromatografi ? Sistem Kromatografi
dibedakan 1. ƒG Cair ? ƒT Padat
- 2. ƒG Gas ? ƒT Padat
- Krom gas Padat GC
6
3. ƒG Cair ? ƒT Cair Krom Partisis ? Krom
Kertas 4. ƒG Gas ? ƒT Cair ? Krom. Gas Cair
GLC ? Krom. Kolom Kapiler .
Semua pemisahan dg kromatografi tgt pada
kenyataan bahwa senyawa-senyawa yang dipisahkan,
terdistribusi sendiri diantara fasa-fasa gerak
dan tetap dalam perbandingan yang sangat
berbeda-beda satu sama lain.
7
KROMATOGRAFI SERAPAN
- ƒT Zat padat berfungsi sebagai adsorben
- ƒG Zat cair
- Permukaan partikel padat biasanya lebih aktif
daripada bagian dalam. Yang pada umumnya
dikatakan mempunyai aktivitas permukaan
Survace Activity. - Bila partikel dimasukkan dalam larutan ?
permukaan partikel mempunyai daya tarik baik
terhadap zat larut atau pelarutnya.
8
- Daya tarik / absorbsi dalam bentuk
- Elektrostastik (Ionik)
- Daya tarik dua dipol
- Antara dipol dan dipol induksi
- Kekuatan Vander Waals
- Partikel padat yang mempunyai aktivitas permukaan
dalam kromatografi dinamakan Adsorben.
9
KESEIMBANGAN ADSORBSI
- Bila larutan mengalir melalui permukaan aktif
terjadi proses adsorbsi dan desorbsi. - Hubungan antara konsentrasi zat yang ada dalam
larutan (CM) dan yang teradsorbsi (CS) terlukis
sebagai berikut
A
Cm
Cs
Bentuk (A) bentuk konveks, terjadi karena adanya
variasi aktivitas dari permukaan yang ada.
Hubungan demikian sering dinamakan Freunddlich
Isotherm yang terjadi umumnya pada sistem padat
cair.
10
B
Cm
Cs
Kurve isoterm garis lurus (B) merupakan keadaan
yang dikehendaki, permukaan ? akan menjadi jenuh
dengan zat yang diadsorbsi. Kemiringan (slope)
dari kurve isoterm garis lurus merupakan koef
distribusi dan ? tergantung besarnya konsentrasi.
11
C
Cm
Cs
Kurve isoterm bentuk konkaf (bentuk C) dihasilkan
dari reaksi yang terjadi sedemikian sehingga
menyebabkan mempercepat proses adsorbsi secara
keseluruhan.
12
- Ketiga macam perbedaan proses adsorbsi
menyebabkan terjadinya distorsi puncak yang
dihasilkan.
Puncak bentuk condong (Tailing) biasanya
diakibatkan adsorben terlalu aktif. Hal ini dpt
dikurangi ? ) menutup sisi aktif dengan zat lain
)menaikkan suhu, ) me(-) banyaknya sampel yang
akan dipisahkan.
13
ADSORBEN
- Alumina dan silika gel. merupakan dua adsorben
yang paling populair penggunaannya. - Contoh urutan absorben sesuai kemampuan
adsorbsi ? ? ? ? - 1. Alumina 5. Kalium Karbonat
- 2. Charcoal / Arang 6. Sukrosa
- 3. Silika Gel 7. Starch / Pati
- 4. Magnesia 8. Serbuk Selulosa
- Aktivitas permukaan setiap adsorben berbeda.
Perlakuan pendahuluan menurut cara-cara yang
ditentukan dapat menghilangkan perbedaan
aktivitas tersebut.
14
Contoh Daya adsorbsi alumina, ? dapat diatur
dengan mengatur kandungan ? air. Alumina ----
3600C / 5 jam, ----- , dibiarkan menyerap air
sampai kadar tertentu yang dinyatakan dalam skala
Brockmann. Alumina berkadar air 3 mempunyai
aktifitas yang umum digunakan. Luas permukaan
alumina 150 m2/g, kadar air cukup 5 untuk
pelapisannya.
15
- Silika gel yang memp luas permukaan ? 500 m2/g
tetapi mempunyai aktivitas kimia lebih kecil,
banyak digunakan untuk pemisahan senyawa organik
yang peka terhadap perubahan-perubahan karena
aktivitas permukaan yang mempunyai sifat katalik. - Hubungan skala Brockmann dan
- kadar air alumina
- Skala Brockmann Kadar Air
- I 1
- II 3
- III 6
- IV 10
- V 15
16
ZAT PELARUT
- ) Zat pelarut mempunyai peranan penting dalam
Elusi yang dapat menentukan baik-buruknya
pemisahan. - ) Zat pelarut yang mampu menjalankan Elusi
terlalu cepat ? ? akan mampu memisahkan secara
sempurna. - ) Elusi yang terlalu lambat ? menyebabkan waktu
Retensi lama. - Sebaiknya zat pelarut ? tergantung dari kekuatan
elusinya. Kekuatan zat elusi ? daya penyerapan
pada penyerap (zat pengisi) kolom.
17
- Kekuatan penyerapan ? dg me ? polaritas zat yang
diserap. - Menurut TRAPPE, kekuatan elusi dari deretan
pelarut dalam kolom dg silika gel, - ? Air Murni ? Metanol ? Etanol ? Propanol
- Aseton ? Etil Asetat ? Dietil Eter ? Kloroform
- Metilenia Cl ? Benzana ? Toluena
- Trikloretilen ? Karbon Tetra Cl ? Sikloheksan
- Heksan.
18
- Menurut Williams pelarut-pelarut dalam kolom
menggunakan carbon aktif untuk pemisahan
asam-asam amino dan sakarida dalam larutan - Adalah
- Etil Asetat ?, Dietil Eter ?, Propanol ?, Aseton
?, Etanol ?, Metanol ?, Air Murni ?. - Catatan pelarut harus betul-betul murni.
19
PENGISIAN DAN CARA KERJA KOLOM
- Pengisian kolom harus dikerjakan dengan seragam.
) Penyeragaman kepadatan dalam kolom dengan
vibrator atau planger, - )atau adsorben dimasukkan ke dalam kolom dalam
bentuk bubur (Slurry) dan partikelnya dibiarkan
me?. - Pengisian ?seragam menimbulkan rongga di
tengah-tengah kolom. - Bagian dasar / bawah dan atas dari isian kolom
diberi glasswool atau sintered glass disc untuk
menyangga isian.
20
Kecepatan elusi sebaiknya ) konstant, dan )tgt
dari ? ukuran partikel bhn isian kolom ?
Dimensi kolom ? Viskositas cairan ? Tekanan
untuk mengalirkan zat pelarut
21
PENANGANAN CUPLIKAN
- Memasukkan cuplikan dari atas kolom merupakan hal
yang sangat penting - ? Cuplikan harus rata
- Dlm keadaan larutan yg sepekat
- mungkin???
- ? Dicegah terjadinya ?
- Dicegah terjadinya penggoncangan
- kolom
- Untuk mendapatkan permukaan rata ? permukaan
penyerap / bahan isian diberi kertas saring atau
pasir yang bersih hingga membentuk lapisan tipis.
22
Pemasukan cuplikan melalui pipet kecil ujung
pipet ditempelkan pada dinding kolom. Selama zat
cair lepas dari pipet, ujung pipet digerakkan
berkeliling dalam kolom, dan diupayakan ?
menyentuh penyerap / bahan isian. Cuplikan yang
tertinggal dalam dinding kolom dicuci dengan cara
yang sama menggunakan pelarut murni. Bila semua
cuplikan telah turun ke bagian bahan penyerap,
bahan pelarut / ƒG dapat dimasukkan melalui
corong pisah.
23
- Dlm kromatografi ini fasa tetap / stasioner ?
berupa zat padat tetapi cairan. - Fasa geraknya juga berupa cairan HPLC High
Performance Liquid - Chromatography.
- Liq-liq Partition Chromatogra phy
- Zat yang dilarutkan akan terdistribusi dg
sendirinya diantara 2 fasa zat cair
24
- Dan sesuai dengan koef partisinya.
- Perbedaan koef partisi dari berbagai komponen ?
campuran dapat dipisahkan. - Keuntungan kromatografi partisi dengan adsorbsi,
karena - Daya ulangnya lebih baik
- Dari data kelarutan, hasil dapat diramalkan
- Koef distribusi konstant dalam jangka yang
agak luas ? dapat menghasilkan puncak yang
simetris lebih tajam
25
Keunggulan HPLC
- 1. Dapat menangani senyawa-2 yang stabilitas
terhadap suhu dan volatilitasnya terbatas, - bila tanpa menggunakan derivatisasi.
- Contoh analisis beberapa jenis gula, dg
- HPLC tanpa derivatisasi
- 2. t pemisahan singkat ? 5 10 menit untuk
- satu sampel.
- 3. Dapat digunakan untuk anal. Kuantitatif dg
- presisi yang cukup tinggi.
- 4. Merup teknisi analisis yg peka,mempunyai
- resolusi yang baik untuk pemisahan senyw
- serupa.
26
Efisiensi maksimal dapat dicapai dg ) mengatur
kecepatan aliran fasa gerak yang kecil, sehingga
analisis memakan waktu yang lama. Untuk
menanggulangi hal ini perlu diperhatikan )
Me ? P aliran ƒ gerak ) Me(-)jarak tempuh zat yg
dianalisis ) dlm proses partisi,dg
menggunakan bahan isian atau penyangga
(Packing Material)
27
- Bahan isian sebagai penyangga harus inert thd
senyawa-2 yang akan dipisahkan. - fT (stasr). Berupa cairan yang dilapiskan pada
permukaan bahan penyangga (Packing Material). - Ikatan antara bahan penyangga dg ƒT , dapat
berupa ikatan fisik maupun kimiawi. - Dua tipe bahan isian yang ada dipasaran ?
Pellicular Beads dan Microporous Prarticle. - ? Pellicula Beads terdiri dari bagian dalam yg
padat, ? berpori, biasanya dari bahan silika,
kulit luar tipis bersifat porous, dg ketebalan
1/30 1/40 dari ? bagian dalam. Besar partikel
keseluruhan ? 40 ?.m.
28
Kelemahan tipe ini ? luar permukaan dari kulit
yang berpori ? ? 1-25 m2/g ? jarang dipakai ?
Microporous Particle / Mikropartikel Ukuran
antara 3-10 ?.m ? memberikan luas permukaan besar
antara 200-300 m2/g ? Efisiensi tinggi karena ?
plat teoritis dapat mencapai 10.000 dalam kolom
sepanjang 25 cm. Kromatografi partisi cair - cair
? ƒT dan ƒG harus ? bercampur.
29
- Pelarut lebih polar digunakan sebagai ƒStat ?
sistem dinamakan Krom Fase Normal. - Contoh
- Air sebagai ƒT yang melapisi silika gel secara
tipis. Air ter-ads. 50 dari berat silika gel.
kadang-2 dipakai sistem buffer. - Untuk menghasilkan tR yang diharapkan jumlah
fraksi terlarut dalam ƒG berkisar 0,05 0,5. - Bila ƒT dipakai senyawa non polar, dan ƒG polar
merupakan kebalikan fase normal. Reverse Phase
Chromatography untuk ini penyangga padat yang
non polar dapat digunakan bubuk karet dengan
lapis tipis benzen sebagai ƒT dan air sebagai ƒG.
30
SUSUNAN PERALATAN
- Pada HPLC dan GLC ? jauh berbeda.
- Komponen utama
- ? Reservoir pelarut untuk fase gerak
- ? Pompa untuk mengalirkan fase gerak / mobile dg
kecepatan dan tekanan tetap - ? Injector untuk memasukkan sampel
- Ada 2 macam ? ? On Coloum
- Injection / Langsung
- ? Holding Loop Injection / ? langsung
31
? Kolom ? Detector ? D. Ultraviolet ? D.
Fluoresens ? D. Konduktivitas ? D.
Indeks Refraksi ? D. FID. Flame
Ionitation
Detector. ? Recorder
32
KOLOM KROMATOGRAFI
- Dapat berupa pipa gelas dg kran dan gelas
penyaring di dalamnya. - Ukuran kolom dan efisiensi kolom dapat dihitung
secara teoritis. - Skema pemisahan dua campuran A danB dengan kolom
kromatografi
33
(No Transcript)
34
KESEIMBANGAN DISTRIBUSI
- Perbedaan migrasi merup hsl distribusi
keseimbangan dr senyawa A, B, C, diantara fTdan
fG. - Distribusi molekul cuplikan antara dua fasa
dinyatakan dlm tetapan keseimbangan dikenal sbg
koef Distr - atau partisi KD
1
CS Kadar senyawa dlm fT (Diam), (fo) CM Kadar
senyawa dlm fG (Mobil), (fa)
35
K, meliputi berbagai macam mekanisme tgt sifat-2
fasa dan interaksi cuplikan dengan setiap fasa.
k ? ? populasi CS ? CM ? Mol cuplikan akan
tinggal lebih lama di ƒSts ƒo
36
Saat Seimbang ?
Kecepatan migrasi ditentukan ? mol dalam fasa
gerak
BS ? BM
AM ? AS
37
Sebagai dasar retensi
- Keseimbangan dinamik
- sebenarnya yang ada ?
faktor kapasitas yang setara dengan CS.VS / CM.VM
38
(No Transcript)
39
Harus selalu 1, karena k0, maka kecepatan
solut tidak pernah lebih besar dari kecepatan ƒM
Ciri khas kedua pemisahan kromatografi ?
penyebaran Mol yang menyebabkan perbedaan puncak
kromatogram.
? Molekul-molekul membentuk garis sempit luas
puncak awal.
40
DIFUSI EDDY
- Perbedaan aliran F gerak
- dalam kolom ? molekul
- cuplikan melewati jalan
- berbeda, tergantung aliran
- yang diikuti.
? Dalam waktu tertentu - Lorong alir ?, kecep.
alir ? ? jarak yang ditempuh molekul
panjang. - Lorong alir ??, kecep. alir ? ?
jarak yang ditempuh mol pendek.
41
? Perpindahan massa ƒG berhubungan dg perbedaan
kecepatan alir setiap bagian dari suatu lorong. ?
ƒG berdekatan dg partikel, akan bergerak lambat /
? bergerak. ? ƒG ditengah aliran bergerak lebih
cepat ? dlm rentang waktu tertentu molekul
cuplikan dekat partikel menempuh jarak
lebih pendek. molekul cuplikan di tengah
aliran menempuh jarak lebih panjang.
42
- Partikel fasa diam yang berpori ƒG yang masuk
dalam pori ? bergerak. - ? Molekul cuplikan bergerak keluar masuk pori
secara difusi - ? Setelah molekul berdifusi dalam pori dan
terikat dengan berbagai cara dalam fasa tetap /
diam ? - - Bila molekul cuplikan
- terikat lama dalam ƒT
- karena difusi terlalu dlm ? menempuh jarak
ke bawah lebih pendek.
43
TEORI KELAJUAN / KECEPATAN
Dikembangkan oleh Van Deemter orang Belanda ?
Pers Van Deemter
- Pers ini berguna untuk meningkat kan
- peranan kolom kromatografi ? efisiensi kolom.
- ? diukur dengan
44
A Difusi Eddy / Dif. Olakan B Difusi
Longitudinal C Transfer. Massa ? Kecepatan
aliran ƒG dlm kolom (cm/dtk)
45
(No Transcript)
46
Hmin dan ?Opt diperoleh dari turunan 1 Pers Van
Deemter ?
47
(No Transcript)
48
Ciri Khas Kurve / Peak. Kromatogram
- Setiap senyawa meninggalkan kolom dalam bentuk
simetri, sebagai kurve gaus - Setiap puncak keluar dlm waktu tertentu, yang
dapat dipakai sebagai identifikasi senyawa - tR waktu retensi diukur mulai waktu injeksi
cuplikan ? waktu puncak maksimum meninggalkan
kolom - Perbedaan waktu retensi tR berdekatan. Semakin
besar ?tR dari campuran semakin mudah dipisahkan
49
RETENSI
- Jika kecpt aliran ƒG dlm kolom µ cm/dtk
- ? kecepatan rata-rata cuplikan x
µx tgt dari µ dan R (Fraksi Mol X dalam ƒG )
50
Hub µ , tR dan panjang kolom L.(cm)
tR waktu retensi ? waktu yang diperlukan fraksi
solut bermigrasi sepanjang lintasan kolom
51
? Dapat terlihat dalam chromatografi
k Faktor Kapasitas
Konsep teori plat dari persamaan binomial
52
Retensi kadang-kadang diukur dengan satuan
Volume VR ? Vol total ƒG yang diperlukan untuk
mengelusi puncak senyawa x. VR tR x kecepatan
alir ƒG melalui kolom F ml/dtk VR tR.F Vol
Total ƒG dalam kolom VM tM.F VR lebih
disenangi dari tR karena tR berubah dengan
berubahnya kecep. alir (F, µ), sedang VR tidak
tergantung pada (F, µ). µ cm/dtk
53
Konsep Teori Lempeng / Plat
Teori lempeng plat, perlu untukmenerangkan proses
terjadinya suatu pemisahan secara kromatografi.
Karena proses yang terjadi pada kromatografi
anlog dengan proses ekstraksi bertingkat yang
dilakukan oleh Craig. Dimana fasa diam dalam
kromatografi dianggap terdiri dari sejumlah ruang
yang mempunyai ukuran sama dan tiap ruang
mengandung sejumlah fasa mobil dan fasa
diam. Dengan teori ekspansi binomial, distribusi
sampel dalam ruang dinyatakan dalam rumus.
54
- Distribusi sampel dlm ruang tersebut merupakan
fungsi dari koef distribusi (KD). Perbandingan
volume pelarut yang digunakan (Vs / Vm) dan
jumlah pemindahan atau transfer (n). - Teori plat dapat menggambarkan kecepatan migrasi
secara kuantitatif tetapi tidak dapat menerangkan
bagaimana terjadinya pelebaran pik. Sehingga
teori tersebut dilengkapi dengan teori kinetik /
teori kecepatan. - sampel.
55
Fraksi waktu tinggal dalam fasa gerak, sbg dasar
RETENSI dinyatakan dlm pers 2, 3, 4 Fraksi waktu
tinggal dalam fasa mobil sama dengan jumlah
molekul dalam fasa mobil dibagi dengan jumlah
total molekul dalam sampel
Fraksi dlm fasa gerak (R)
(R)
k K.Vs/Vm .. (3) ? faktor kapasitas setara
Cs.Vs/Cm.Vm
Besaran-besaran dlm kromatografi
56
WAKTU RETENSI
- Apabila kecepatan alir fm (u, cm/dtk) diatur
tetap, t tetap, perbandingan fasa diam dan fasa
mobil tetap, ? setiap komponen dalam suatu sampel
akan mempunyai waktu tinggal yang tetap, yaitu
waktu yang diperlukan oleh suatu komponen untuk
melintasi suatu fasa diam dengan panjang L.(cm) ?
waktu retensi (tR)
57
Bila kecepatan rata-rata cuplikan x ux, maka ux
akan tergantung dari u dan R (fraksi mol x dalam
fm)
58
Hubungan u dg tR dan panjang lintasan L(cm) ? tm
waktu yang diperlukan oleh fasa mobil itu
sendiri (tanpa sampel) untuk keluar dari fasa diam
Konsep teori lempeng / plat
59
FAKTOR SELEKTIFITAS ?
Untuk pemisahan 2 zat terlarut A, B ? melalui
kolom kromatografi ? perlu diketahui faktor
selektivitas A, B
KB, KA adalah Koef Partisi A dan B
k Faktor Kapasitas
Dalam eksperimen ?
tR? t terkoreksi
60
RESOLUSI KOLOM Rs
METODA LUAS PEAK ?
61
- Resolusi perubahan nyata antara dua spesies B,
A dalam kolom - Dari grafik resolusi terbaca 3 bentuk resolving
power yang ? sama. - Rs 1,5 Memisahkan A dan B secara komplit,
meskipun masih ada over lap 0,3. Resolusi Base
Line - Rs 1,0 Daerah peak B masih mengandung A 4 -
2,5 dan sebaliknya - Rs 0,75 A dan B belum sama sekali terpisahkan
62
- Utk pemisahan yg baik R 1,5 ? 99,7
- Pemisahan spesies dlm kromatografi erat
hubungannya dengan faktor-faktor - Efisiensi kolom 2. Efisiensi pelarut
- Eff kolom diukur sbg ? plat teoritis N,
- Ketinggian ekivalen terhadap plat teoritis HETP
63
L Panjang Kolom
dari pers. Gauss ?
? stand deviasi pengamatan ? Pers. Gauss ?
standard deviasi Peak Kromatografi
64
Daerah kurve Gauss maks, termasuk diperhitungkan
2 standard deviasi 2 ? Sehingga dalam
perhitungan intersep kurve maks diperhitungkan
pula kira-kira 2 ?.
65
W Lebar puncak yg diukur pada perpotongan
tangen dan garis dasar
66
Catatan tR, W diukur dg satuan yang sama. Cara
lain untuk menghitung / memperkirakan N ? dg
membandingkan terhadap W ½ Lebar ½ H.
29
67
Hubungan Antara Rs dan Kolom
- Hub matematis antara RS, kB, kA, ? dan N.
- Dengan asumsi WA W? W
Maka Pers (18) RS
Pers (28) N
68
Eliminasi kA dg substitusi ? kB/kA
69
Bila diasumsikan WA WB W
70
Gambar Pemisahan Sebagai Fungsi RS dan Kadar
Relatif
Dari penjabaran rumus, diketahui bahwa untuk
mengatur resolusi k dan N berpengaruh, sedang
71
Gambar Perubahan k, N, ? terhadap Resolusi
72
- Dari pers. RS terhadap ?, N, k, ternyata faktor
(i), (ii), dan (iii) ? saling bergantung, dengan
demikian dapat dioptimalkan dulu faktor (i) baru
yang lain. - Selektivitas pemisahan ditunjukkan faktor ? yang
berubah dengan mengatur susunan ƒgerak dan
ƒtetap. - ? Me ? ? ? pergeseran satu puncak relatif
terhadap lainnya. - ? Waktu pemisahan dan tinggi dua puncak ? begitu
berubah untuk perub ? yang wajar.
73
Efisiensi pemisahan ditunjukkan faktor (ii) N,
dengan mengubah L dan µ, N suatu kolom di ?, ?
menghasilkan penyempitan dua puncak dan menaikkan
tinggi puncak. Waktu pemisahan ? langsung
dipengaruhi. Faktor (iii), k berubah dengan
mengubah kekuatan fasa gerak. Perubahan k dapat
berpengaruh besar pada pemisahan. k ? ?
perubahan jelek, tR pendek. k ? ? terjadi
kenaikan nyata resolusi, meskipun tinggi puncak
turun cepat dan waktu pemisahan naik.
74
Pengaruh ? Cuplikan
75
- Dari gambar cuplikan kromatogram terlihat /
terbaca - a. Cuplikan sedikit, ? Tinggi puncak naik
- dg bertambahnya
cuplikan - ? tR ? dipengaruhi ? RS tetap
- b. Jumlah Cuplikan Kritik, - waktu retensi
menurun - c. d. Pe () cuplikan berlanjut, ? Terjadi
penurunan nyata pada pemisahan dan tR. - Untuk pemisahan analitik, lebih baik bekerja pada
daerah dimana k tetap, yaitu ? cuplikan harus
kurang dari kapasitas linear kolom.
76
PUNCAK BEREKOR Pada sistem Kromatografi yang
baik, setiap puncak merupakan kurve GAUSS
SIMETRI. Puncak berekor kadang-kadang muncul
dalam kromatogram, dengan 4 bentuk kemungkinan
77
- A Terjadi karena ketidak cocokan antara cuplikan
dengan ƒG atau ƒT. Ditandai dengan lambat kembali
ekor puncak pada garis dasar - Pemisahan terhadap puncak berikutnya jadi jelek
- Jika terjadi puncak berekor tipe ini, perlu
dicoba ƒG, ƒT yang lain atau dicoba metoda lain
Bentuk A Berekor Kimia
78
Bentuk B Berekor Pelarut
- B Akibat dari puncak pelarut cuplikan
- Penggunaan cuplikan sedikit mungkin, atau
menaikkan RS - C Terjadi karena kolom kurang efisien, efisiensi
kolom ??. - Jarang terjadi pada kromatografi cairan
- D Puncak sedikit kurang simetri dan ini biasa
terjadi pada semua kromatografi
Bentuk C Poisson
Bentuk D Eksponansial Normal
79
KROMATOGRAFI PLANAR
- Thin Layer Chromatography TLC KLT.
- Teknik ini dikembangkan oleh EGON STAHL dengan
menghamparkan penyerap pada lempeng gelas
sehingga merupakan lapisan tipis.
80
- KLT cepat populair karena memberikan banyak
keuntungan - Peralatan sederhana
- Murah
- Waktu analisis cepat
- Daya pisah cukup baik
- Sebagian besar teori kolom dapat diterapkan pada
KLT. - Pemisahan dilakukan oleh keseimbangan berturutan
cuplikan terhadap dua fasa, satu diantaranya
bergerak terhadap yang lain.
81
Derajat retensi pada KLT dinyatakan sebagai
- Jarak yg telah ditempuh pelarut dapat diukur
dengan mudah dan jarak tempuh cuplikan diukur
pada pusat kerapatan maksimum.
82
Hubungan koefisien distribusi dengan Rƒ ?
AM, AS luas penampang melintang dua fasa (tegak
lurus lempeng)
83
- Luas penampang melintang sukar diukur ? persamaan
di atas kurang praktis, - Rƒ merupakan bentuk modifikasi dari tetapan
keseimbangan. - Rƒ terbentuk dari
- macam adsorben, ketebalan,
- metoda arah pengembangan,
- kadar dan jumlah cuplikan, serta
- jarak yang ditempuh / noda.
84
Dengan melihat ketergantungan harga Rƒ ? akan
lebih mudah dan tepat menggunakan harga Rƒ
relataif atau R standard. Dimana suatu senyawa
standard di () ke cuplikan. Harga RSTD adalah
angka banding jarak tempuh dua bercak tersebut
dalam waktu pengembangan yang sama.
85
(No Transcript)
86
FAKTOR KAPASITAS
- Persamaan-2 yang telah dijabarkan dapat
diadaptasi pada TLC. - tR, tM waktu yang dibutuhkan senyawa bergerak
dalam fasa ? dR - Bila µ kecepatan linier
87
(No Transcript)
88
- Semua prosedur kromatografi, kondisi optimum
untuk suatu pemisahan merupakan kecocokan antara
f tetap dan f gerak. - KLT / TLC fasa tetap berupa lapis tipis, pada
umumnya digunakan silika gel. - Untuk penggunaan dalam suatu tipe pemisahan
perbedaan fasa tetap terletak pada - Struktur
- Pori-pori
- Struktur lubang
89
- Silika gel perdagangan
- Ukuran 10 - 40µ ? berpengaruh pada µ
- dan pemisahan
- ? Ukuran 20 1500A
- 80 150 pori besar
- ? Luas permukaan 300 1000m2/g
- ? Kelembaban relatif 45 75 mengikat air 7
20 - ? Sangat higroskopis
- ? Deaktivasi ditentukan kelembaban relatif kamar
dan penyimpanan lempeng silika gel ? perlu
diperhatikan
Berpengaruh pd proses serapan
90
Macam-macam gel di perdagangan
- Silika gel dg pengikat
- silika gel G dg pengikat - CaSO4 5-15
- silika gel S dg pengikat - pati
- 2. Silika gel dg pengikat dan indikator
- flourisense
- ? Silika gel GF atau GF 24
- Berflourisens kehijauan jika dilihat dg UV
- ? pendek.
- Indikator yg digunakan timah-kadmium
- sulfida atau mangan-timah silikat aktif.
- 3. Silika gel tanpa pengikat
- Silika gel H atau silika gel N.
- Lebih stabil dibanding bentuk I.
91
4. Silika gel tanpa pengikat dengan indikator
flourisense. 5. Silika gel untuk pemisahan
preparatif. Silika gel PF254 366 6. Alumina
dengan pH 9, 7, 4 Dengan pengikat CuSO4 7.
Selulosa, sebagai fasa diam KLT ? diperoleh
mekanisme sama pada krom. kertas Selulosa untuk
KLT ada 2 bentuk - serat asli -
Monokristal Pemilihan fasa gerak pada KLT dengan
silika gel / alumina sebagai ft, mengikuti aturan
kromatografi serapan.
92
PELARUT SEMI MIKROSTOP (Menurut kenaikan sifat
Hidrofob) banyak digunakan.
- ? Kloroform biasanya distabilkan dengan Etanol
- ?) Air n. Anil Alkohol
- Formanida Etil Asetat
- Metanol Eter
- Asam Asetat n. Butil Asetat
- Etanol Kloroform
- Isopropanol ?)) Benzena
- Aseton Siklo Heksan
- n. Propanol Eter Petroleum
- Tert-butanol Petroleum
- Fenol m. Parafin
- n. Butanol
- ?) Untuk pemisahan senyawa Hidrofil
- ?)) Untuk pemisahan senyawa Lipofil
93
METODOLOGI
- 1. Pembuata Lempeng Lapis Tipis
- ? Ukuran lempeng gelas yang biasa digunakan 20 x
20, 20 x 10, 20 x 5 cm - ? Pencucian - Air () deterjen ?Keringkan
- - Aseton ? keringkan
- ? Pelapisan - 30 g bahan pelapis dibuat
bubur dengan air atau pelarut lain - - Pindahkan dengan segera dalam alat
perata. - - Ratakan bubur pada lempeng dengan
ketebalan 0,25mm - Untuk pemisahan preparatif tebal lapisan 0,5
2,0 mm. - ? Pindahkan lempeng pada rak dengan hati-hati,
diamkan 30 menit - ------- t 100 1200C 1 jam
- ? Simpan dalam Desikator
94
Perbandingan Bahan dan Pelarut untuk Lempeng
PENOTOLAN CUPLIKAN? Lempeng lapis tipis
konvensional (20 x 20, 20 x 10, 20 x 5) dengan
tebal 0,2 mm. Cuplikan ditotolkan sebagai bercak
bulat dengan diameter 3 6 mm, atau berupa
garis 1,5 2 cm dari tepi bawah.
95
PENOTOLAN CUPLIKAN? Lempeng lapis tipis
konvensional (20 x 20, 20 x 10, 20 x 5)
,dengan tebal 0,2 mm. . Cuplikan ditotolkan
sebagai bercak bulat dg diameter 3 6 mm, atau
berupa garis 1,5 2 cm dari tepi bawah.
96
- Penotolan dengan mikro pipet atau microsyringe
diperlukan 1 20 µL. Kelebihan bahan totolan
menyebabkan bercak asimetri danperubahan harga
Rƒ. - HETP pada KLT biasanya 10 x 10, 10 x 20 cm.
diperlukan cuplikan dalam nano ? pikogram setiap
bercak. Diameter bercak harus tidak lebih 1,0
1,5 mm dan vol cuplikan 0,2 µL.
97
PENGEMBANGAN KROMATOGRAM
Kromatogram biasanya dikembangkan dlm bejana
pengembang gelas atau logam yg tertutup dan jenuh
dengan uap pelarut.
98
Teknik Perbaikan Pemisahan
- Pengembangan Berkelanjutan
- ƒ gerak dialirkan pada bagian atas lempeng
pengembang. Teknik ini digunakan untuk senyawa
dengan Rƒ 0,05 0,2 setelah pengembangan pertama.
99
Pengembangan Dua Dimensi Cuplikan ditotolkan di
salah satu pojok kemudian dikembangkan seperti
biasa. Kemudian diputar 900 sehingga pita
pemisahan I terletak pada bagian bawah lempeng ?
dilakukan pengembangan II sehingga terjadi
pemisahan berbeda pada arah kedua. Teknik ini
berguna untuk cuplikan yg mengandung banyak
penyusun.
100
Pengembangan Serkuler Fasa gerak dialirkan
dengan sumbu atau pompa melalui pipa kapiler
ditengah lapisan / tetap. Senyawa terlarut
bergerak dari tengah penotolan menghasilkan
lingkaran-lingkaran sempit. Pengembangan
Beberapa Kali Fasa gerak biasanya mudah menguap,
diuapkan setelah terjadi pengembangan. Lempeng
dikembangkan lagi dengan ƒG yang sama atau
berbeda.
101
METODA IDENTIFIKASI
- Untuk melihat senyawa ? berwarna pada lempeng
pengembang, biasanya dilakukan metoda sebagai
berikut - 1. Dengan UV (254 366 mm)
- a. Pada lap berfluorisensi (S GF254)
- bercak muncul sebagai bercak
- hitam.
- b. Senyawa berfluorisensi, pd lapisan
- biasa bercak akan terlihat
- berfluorisensi.
102
2. Disemprot pereaksi yg menghasilkan
warna atau berfluorisensi. Digunakan utk deteksi
asam sulfat, (H2SO4 p., 50 H2SO4, 50
H2SO4 dlm Metanol). Reaksi ini terbentuk
dlm keadaan dingin atau dg --------100
-1200C - ? dapat digunakan pada ft organik
atau sbg bahan pendukung pati - Pereaksi
lain yg banyak igunakan uap iodium
103
(No Transcript)
104
Faktor yg mempengaruhi gerakan noda dlm KLT yang
juga berpengaruh terhadap Rƒ
- 1. Struktur kimia senyawa yang dipisahkan.
- 2. Sifat adsorben dan derajat aktivitasnya.
- Aktivitas di ? kan dg pemanasan dlm oven.
- 3. Tebal dan kerataan lapisan penyerap.
- 4. Pelarut o kemurnian f gerak.
- - Kemurnian pelarut sangat penting
- - Perbandingan campuran pelarut perlu
diperhatikan. - 5. Derajat kejenuhan uap dalam bejana
pengembangan. - 6. ? cuplikan yang digunakan
- Tetesan cuplikan ?? ? Tendensi penyebaran
noda - Kesalahan harga Rƒ ? Terbentuknya ekor
- ? Efek kesetimbangan lain
105
7. Suhu, pemisahan sebaiknya pada suhu tetap Hal
ini terutama untuk mencegah perubahan-perubahan
dalam komposisi pelarut karena penguapan,(
perubahan fasa). 8. Kesetimbangan Kesetimbangan
dalam KLT lebih penting dalam krom. kertas ?
perlu diupayakan atmosfer dalam bejana jenuh
dengan uap pelarut. Gejala atm. bejana ? jenuh ?
pengembangan dengan permukaan pelarut cekung,
fasa gerak bergerak lebih berat di bagian tepi ?
.. harus dihindarkan.
106
KROMATOGRAFI KERTAS
- ? Prinsip sama KLT, hanya fasa tetap digunakan
kertas bukan lempengan. - Pelarut bergerak melalui serat-serat kertas oleh
gaya kapiler, dan menggerakkan komponen
cuplikan. Pada perbedaan jarak dalam arah aliran
pelarut.
107
Bila permukaan pelarut mulai bergerak sampai
waktu tetentu/ditetapkan, kertas Diambil dan
dikeringkan. Kedudukan dari permukaan pelarut
dibe ri tanda. Jika senyawa campuran berwarna
?akan terlihat noda yang terpisah Bila tdk
berwarna ?perlu diteksi dg UV,di Metoda
identifikasi yg plg mudah dengan Berdasar
kedudukan noda relatif terhadap Permukaan
pelarut dg harga Rf
108
(No Transcript)
109
BEBERAPA FAKTOR PENENTU Rƒ
- 1. Pelarut ? pentingnya koefisien partisi
- 2. Suhu ? perubahan suhu merubah koefisien
- partisi dan kecepatan alir
- 3. Ukuran bejana ? vol. bejana
- mempengaruhi homogenitas atmosfer jadi
- mempengaruhi kecepatan penguapan
- komponen pelarut.
- 4. Kertas ? sesuai jenis berpengaruh thd
- keseimbangan partisi.
- 5. Sifat campuran.
110
APLIKASI DATA ANALISIS
- 1. Substan A dan B mempunyai waktu retensi tRA
16,40 tRB 17,63 menit pada kolom 30 cm. Lebar
dasar puncak A 1,11 dan B 1,21 menit. Hitung
- a. RS resolusi kolom
- b. N ? rata-rata plate dalam kolom
- c. H tinggi plate orisinil
- d. Panjang kolom untuk mencapai RS 1,5
- e. Berapa waktu yang dibutuhkan untuk mengelusi B
dari kolom (d) - f. Berapa tinggi plate dibutuhkan untuk RS 1,5
pada kolom orisinil 30 cm dan waktu orisinil
111
Penyelesaian
112
d. k dan ? ? berubah dengan kenaikan N ataupun L
? substitusikan N1 dan N2 pada persamaan
113
Elusi B dalam kolom (?) dengan RS 1,5
membutuhkan waktu 35 menit.
114
f. Dari persamaan (e) H1 dan H2
disubstitusikan
H1 H orisinil H2 H baru untuk mencapai RS
1,5 dg L.tR.orisinil
115
- 2. KLT dipakai untuk memisahkan campuran 3
carbamate insektisida - 1) Carbofuran
- 2) Carbaryl
- 3) Metalkamate
- Sampel 5 µL larutan mengandung 1 mg/mL setiap
komponen dalam CHCl3 - Fasa gerak toluen / isoprophyl ether 70 / 30.
KLT 20 x 20 cm - ? Cuplikan ditotolkan sebelah kanan KLT
- ? Standard dari 3 komponen sebelah kiri KLT
- Dari pengamatan dengan ukuran cm diperoleh data
- dM 9,8
- dR)1 1,7 W1 0,57
- dR)2 2,5 W2 0,54
- dR)3 3,9 W3 0,75
Hitung a. Rƒ untuk ketiga carbamate b. Tinggi
plate untuk setiap spot (noda)