Slide sem t - PowerPoint PPT Presentation
1 / 70
Title: Slide sem t
1
BIOREATORES - MBR
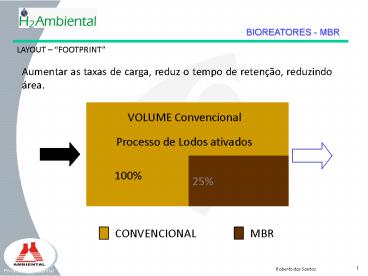
LAYOUT FOOTPRINT
Aumentar as taxas de carga, reduz o tempo de
retenção, reduzindo área.
VOLUME Convencional
Processo de Lodos ativados
25
100
CONVENCIONAL
MBR
2
BIOREATORES - MBR
PRINCIPAIS TIPOS DE MBR CONFORME CONFIGURAÇÃO DO
PROCESSO 1 Imersão - 1.1 - FS - Flat Sheet
3
BIOREATORES - MBR
PRINCIPAIS TIPOS DE MBR CONFORME CONFIGURAÇÃO DO
PROCESSO 1 Imersão - 1.2 HF Hollow Fiber
4
BIOREATORES - MBR
PRINCIPAIS TIPOS DE MBR CONFORME CONFIGURAÇÃO DO
PROCESSO 1 Imersão - 1.3 MT Multi Tube/CT
Capillary tube
5
OPERAÇÃO BÁSICA DE MBR
TANQUE DAS MEMBRANAS
Suprimento de ar
Filtrado
MemPulse MBR
Licor Misto
6
FATORES CRÍTICOS MBR
CONFIGRAÇÃO BÁSICA DE MBR
Q
RQ
Q
DO lt 0.2mg/L NO3- ? N2
DO gt 1mg/L NH4 ? NO3-
(R1)Q
5Q
Ar
7
OSMOSE
8
OSMOSE REVERSA CARACTERISTICAS DE ÁGUA DE
ALIMENTAÇÃO
- TDS 100-15000 mg/L
- Remoção de sais 90-99
- Recuperação de água 50-80
- Fe lt 0,05mg/L
- Cloro livre - isento
9
OSMOSE REVERSA CARACTERISTICAS DE ÁGUA
PRODUZIDA
- Remoção de salinidade (90-99)
- Remoção de compostos orgânicos
- Remoção de amoníaco
- Remoção de metais pesados
- Remoção de alumínio e fluoreto
- SDI lt1
10
OSMOSE REVERSATeste de SDI
- SDI (100/15) x 1-(t0/t15) onde
- t0 tempo, expresso em segundos, gasto no
sistema do teste, para encher 500 ml de um
recipiente - t15 tempo, expresso em segundos, gasto após 15
minutos de teste, para encher 500 ml de um
recipiente.
11
OSMOSE REVERSATaxa de fluxo
- GFD Q/(AxN) onde
- GFD taxa de fluxo
- É função da característica da água de entrada
no sistema e de seu SDI. Define a quantidade de
membranas necessárias para o sistema de osmose. - Q Variação de produção do sistema
- A Área utilizada na membrana
- N Quantidade de membranas.
12
OSMOSE REVERSA LIMITAÇÕES
- Alto consumo de energia elétrica
- Alto percentual de água rejeitada
- Alto custo de pré tratamento
- Consumo de anti incrustante
- Saturação das membranas
- Não é seletivo para sílica
- Não tolera cloro livre
- Não alcança níveis de condutividade para caldeira
necessitando leito misto complementar
13
OSMOSE REVERSA TIPOS DE REJEITOS (CONCENTRADOS E
MEMBRANAS)
- Incrustantes (CaCO3, CaSO4, BaSO4, sílica)
- Matéria orgânica (ácidos únicos, óleos,
coagulantes) - Coloides (sílica, argila, areia, óxidos)
- Material biológico (algas, limo, bactérias)
14
OSMOSE REVERSA CONFIGURAÇÕES
15
TROCA IÔNICAPrincipais aplicações
- Abrandamento
- Alimentação de caldeiras (BP)
- Polimento de condensado
- Desmineralizãção da água
- Alimentação de caldeiras (MP e AP)
16
PROCESSOS DE TROCA IÔNICA CATEGORIAS
- Substituição
- Separação
- Remoção
17
PROCESSOS DE TROCA IÔNICA CICLOS
- Exaustão
- Retrolavagem
- Regeneração
- Lavagem
- Descarte
18
PROCESSOS DE TROCA IÔNICA BASES PARA PROJETO
- Análise completa da água a ser tratada
- Produção do efluente requerido
- Tipos de resina
- Números de horas do ciclo operacional
- Tipo de regenerante a ser utilizado
19
TROCA IÔNICA
- Volume de resinas em cada vaso
- Definido pelo ciclo operacional
- Utilização de torre de decantação
- Depende da quantidade CO2
- Quando é utilizado
- Depende do padrão de água requerido
20
TROCA IÔNICA CARACTERÍSTICAS
- Composição co-polímeros de estireno ou acrílico
e de divinilbenzeno - Resinas catiônicas fortes são obtidas por adição
de SO3 - Resinas aniônicas fortes são obtidas por adição
de aminas - Recomendadas até 500 mg/L de STD
21
TROCA IÔNICA LAVAGEM E REGENERAÇÃO DOS LEITOS DAS
RESINAS
ORIGEM REJEITO
Abrandadores Cloreto de sódio
Leito catiônico Ácido clorídrico ou sulfúrico
Leito aniônico Hidróxido de sódio
22
LEITO MISTOCONCEITUAÇÃO
- Vaso de pressão composto de resinas catiônicas e
aniônicas que promovem o polimento de água
ultrapura já tratada por osmose reversa ou troca
iônica. - O controle de qualidade é feito por meio de
condutivimetro ou análise de sódio.
23
PROCESSOS DE TROCA IÔNICA LEITO MISTO
- Utilizado como complemento a troca iônica e
osmose reversa - Produz água desmineralizada lt 1micro s/cm
24
LEITO MISTO
- Duração do ciclo
- 5 a 10 dias
- Regeneração das resinas
- Feita em duas etapas ácida e alcalina não
simultâneas, com enxágue do leito entre estas
etapas.
25
LEITO MISTOProdução de água ultrapuraFAIXAS DE
VARIAÇÃO
- EDI 0-2 mg/L
- Troca Iônica 2-40 mg/L
- Zona de transição 40-60 mg/L
- Osmose reversa gt40 mg/L.
26
QUALIDADE PARA CALDEIRAS DE ALTA PRESSÃO 80 bar e
470C
- Sílica lt 10ppm
- Condutividade lt 0,2µs/cm
27
ELETRODIÁLISE REVERSA CARACTERÍSTICAS DA ÁGUA DE
ALIMENTAÇÃO
- TDS 400-3000 mg/L
- Turbidez lt0,5 NTU
- DQO lt50 mg/L
- OG lt2mg/L
- Fe lt0,5 mg/L
- Cloro livre lt0,3mg/L
- Outros
28
ELETRODIÁLISE REVERSA CARACTERÍSTICAS DA ÁGUA
PRODUZIDA
- Remoção de sais 50-95
- Recuperação de água 85-94
29
ELETRODEIONIZAÇÃO (EDI)O que é?
- Tecnologia que utiliza processo eletroquímico
capaz de remover sais do meio líquido,
objetivando a obtenção de água pura.
30
ELETRODEIONIZAÇÃO (EDI) Conceituação
- A corrente elétrica promove a remoção de sais
iônicos da água enquanto regenera continuamente
as resinas de troca iônica com H e OH- através
da dissociação de sais na água.
31
ELETRODEIONIZAÇÃO (EDI) Como funciona?
- Aplica-se uma corrente elétrica em placas fixadas
ao longo de cada módulo - A placa carregada positivamente (ânodo) atrai ao
anions - A placa carregada negativamente (catodo) atrai os
cátions - Membranas seletivas e resinas de troca iônica
destinadas ao transporte dos ions completam o
sistema.
32
ELETRODEIONIZAÇÃO (EDI) Usos
- Polimento em sistemas de desmineralização para
caldeiras de alta pressão - Indústrias farmacêuticas
- Indústrias de equipamentos eletrônicos
- Indústrias alimentícias.
33
ELETRODEIONIZAÇÃO (EDI) VANTAGENS COM RELAÇÃO AO
LEITO MISTO
- Ausência de produtos químicos
- Requer diminuta necessidade de mão de obra
- Sistema mais confiável que o leito misto
- Demanda pouca limpeza (a cada 6 meses)
- Funcionamento contínuo
- Área menor
- Menos custos operacionais
- Qualidade de água produzida é constante.
- (Si lt 5ppb e 10 a 8 mega ohm/cm)
34
ELETRODEIONIZAÇÃO (EDI) DESVANTAGENS
- Maior sensibilidade à variação da alimentação
- Limites baixos de dureza
- (lt1 mg/L de CaCo3 e Silt 1 mg/L)
35
ELETRODEIONIZAÇÃO CARACTERISTICAS DA ÁGUA DE
ALIMENTAÇÃO
- Turbidez lt 0,1 NTU
- TOC lt 0,5mg/L
- Fe lt 0,01mg/L
- Cloro livre lt 0,05 mg/L
- Condutividade lt 43 micro s/cm
- Dureza total lt 0,5mg/L
- Sílica lt 0,5 mg/L
36
ELETRODEIONIZAÇÃO CARACTERISTICAS DA ÁGUA
PRODUZIDA
- Sílica 1-10 ppb
- Condutividade lt 0.1 µs/cm
- Produção de água ultrapura PWeWFI
37
ELETRODEIONIZAÇÃO (EDI) Características da água
de alimentação e da água produzida
38
PROCESSOS OXIDATIVOS
39
DEFINIÇÕES BÁSICAS
Oxidação
Conceito Clássico - A Química clássica
considerava a oxidação como a combinação de uma
substância com o oxigênio. De certa forma a
redução seria o processo inverso a diminuição do
conteúdo de oxigênio de uma substância. Conceito
Atual - Se considera que uma substância se oxida
quando perde elétrons e que se reduz quando os
ganha. Uma substância não pode se oxidar se outra
não se reduzir, pois os fenômenos de oxidação e
redução envolvem sempre uma transferência de
elétrons. Quando o magnésio se oxida, por
exemplo, perde dois elétrons (Mg ? Mg2 2 e ).
Essa oxidação pode ser produzida por um átomo de
oxigênio, que ganha dois elétrons (O 2e ?O 2
), ou dois átomos de cloro, cada um deles
ganhando um elétron (2 Cl 2 e ?2 Cl ).
Nos dois casos houve uma oxidação do magnésio,
mesmo que no segundo não tenha oxigênio
envolvido.
40
DEFINIÇÕES BÁSICAS
Tipos de Oxidantes
- Ozônio
- Peróxido de Hidrogênio
- Peróxido de Cálcio
- Persulfato de Sódio
- Permanganato de Sódio/Potássio
41
MECANISMOS DE REAÇÃO ENTRE OH E CONTAMINANTES
42
PROCESSO DE SELEÇÃO - OXIDANTES
1
Escolher outra Tecnologia
H2O2
N
Demanda de oxidante é alta?
N
2
KMnO4
S
???
Este composto é Oxidável?
Triagem de oxidantes
Seleção do Oxidante
3
Persulfato
S
É estável?
4
N
Amostra
S
Ozônio
Continua o projeto do processo
S
S
Escolher outra Tecnologia
Demanda de oxidante é alta?
S
É estável?
N
43
ADVANCED OXIDATION PROCESSED (AOP)
ULTROX
44
PROCESSOS OXIDATIVOS AVANÇADOS (POA) MECANISMO
- Formação de radicais hidroxila por combinação de
oxidantes e catalizadores como íons metálicos - Na oxidação de um composto orgânico há diferentes
reações envolvendo o radical hidroxila, como
abstração de hidrogênio gerando radicais
orgânicos que reagindo fortemente com oxigênio
leva a degradação até gás carbônico - RH OH R H2O
- R O2 RO2
45
OXIDAÇÕES ATRAVÉS DE REAGENTES FENTON
Os radicais OH formados oxidam as substâncias
orgânicas. No caso do reativo de Fenton, muitas
vezes, esta oxidação não leva à mineralização
total dos poluentes. O material é inicialmente
transformado em alguns produtos intermediários
que são resistentes às reações de oxidação
posterior. Isto se deve a complexação destes
intermediários com os íons Fe(III) e às diversas
combinações que podem ocorrer com radicais OH
(reações competitivas).
46
PROCESSO FENTON
- A geração do íon OH é obtida através da reação
do peróxido de hidrogênio e íons ferrosos. A
reação que quando ocorre em pH baixo resulta mais
eficiente - Fe H2O Fe OH OH
- Fe OH Fe OH
2
-
3
2
-
3
47
PROCESSO FENTON
- No processo foto-fenton a taxa de regeneração dos
íons férricos é ainda mais acentuada em razão de
produzir ainda mais radicais hidroxilas - Fe H2O Fe HO OH
UV
2
3
48
FLUXOGRAMA DE POA FOTO-OXIDAÇÃO H2O2 RADIAÇÃO
UV
UV
H2O2
49
FLUXOGRAMA DE POA FENTON
Fe
H2O2
50
FLUXOGRAMA DO POA PEROX-OZONIZAÇÃO H202 O3
51
CENTRIFUGAÇÃO DE LODO
52
FILTRO PRENSA
53
EVAPORAÇÃO DE LODOS
54
DESAGUAMENTO DE LODOS EM TUBOS DE GEOTEXTIL
55
ENSAIOS DE TRATABILIDADE
- Ensaios físicos
- Sedimentação
- Desidratação
- SDI
56
ENSAIOS DE TRATABILIDADE
- Ensaios físico - químico
- Coagulação / Floculação
- Flotação a ar dissolvido
- Carvão ativado
- Processos oxidativos avançados
57
ENSAIOS DE TRATABILIDADE
- Ensaios Biológicos
- Taxa de consumo de oxigênio
- Taxa de depleção de oxigênio
- Lodos ativados
58
TAXA DE CONSUMO DE OXIGÊNIO (Rr)
ODf - ODi Rr (mg/L.min)
t1 t2
59
TAXA DE DEPLEÇÃO DE OXIGÊNIO (TDO)
Rt TDO
(mg/g.h)
SSV (g/l)
60
TDO (TAXA DE DEPLEÇÃO DE OXIGÊNIO)
Exemplo OD2 8mg/L OD10 2,5mg/L SSV 3 g/L
8mg/L 2,5 mg/l Rr
0,7 mg/L.min
10min-2min 0,7
mg/L min 60 min TDO
x 14 mg/gh
3g/L hora
61
ANEXO Número de oxidação
62
NÚMERO DE OXIDAÇÃONOX
- O número de oxidação de um átomo está associado a
perda ou ganho de elétrons na última camada em
uma ligação iônica ou covalente quando de uma
reação química. - Se um átomo perde elétrons ele fica com prótons a
mais e o NOX é um número positivo correspondente
à diferença entre prótons e elétrons. Diz-se que
o elemento se oxidou. - Se um átomo ganha elétrons ele fica com prótons a
mais e o NOX é um número negativo correspondente
à diferença entre prótons e elétrons. Diz-se que
o elemento se reduziu.
63
REAÇÃO DE OXI-REDUÇÃO
- Fe 2HCl H2 FeCl2
- 0 1 0
2 - Nesta reação o Fe se oxidou enquanto o
hidrogênio se reduziu. O ferro é o agente redutor
pois provocou a redução do hidrogênio e o
hidrogênio é o agente oxidante, pois provocou a
oxidação do ferro. - Quem perde elétrons se oxida e quem ganha
elétrons se reduz.
64
(No Transcript)
65
NÚMERO DE OXIDAÇÃONOX
- Exemplos
- O oxigênio possui 6 elétrons na última camada.
Logo, a tendência será receber 2 elétrons para
formar um octeto. Neste caso, terá 2 elétrons a
mais do que o número de prótons. Neste caso o
NOX-2. - O Fe² tem NOX2 pois perdeu 2 elétrons de sua
última camada em uma reação química com oxigênio.
Neste caso, o Ferro se oxidou e o oxigênio se
reduziu. - Fe e O2 possui NOX0
66
REAÇÃO DE OXI-REDUÇÃONúmero de oxidação
- Número de oxidação de um elemento é a carga que
ele recebe na reação química. - Exemplo Calcular o Nox de S em H2SO4.
- Da tabela periódica tem-se
- 2(1) S 4(-2) 0
- 2 S 8 0
- S 6
- O Nox do enxofre (S) 6
67
- Exemplo Calcular o Nox de P em P2O7
- Da tabela periódica tem-se
- 2P 7(-2) (-4)
- 2P -14 -4
- 2P 10
- P 5
-4.
68
-3
- Exemplo AsO4
- Da tabela periódica tem-se
- As 4(-2) -3
- As 8-3
- As 5
- Exemplo AsO3
- Da tabela periódica tem-se
- As 3(-2) -3
- As 6-3
- As 3
-3
69
- Exemplo Calcular o Nox de Cl em HClO .
- Da tabela periódica tem-se
- 1(1) Cl (-2)
- Cl 1
- Neste caso o NOX de cloro é 1
- Exemplo Calcular o NOX do Cloro em HCl.
- Da tabela periódica tem-se
- 1 (1) 1Cl 0
- Cl -1
- Neste caso o NOX de cloro é -1
70
- OBRIGADO
- Engº José Eduardo W. A. Cavalcanti
- cavalcanti_at_novaambi.com.br