Equilibrio qumico - PowerPoint PPT Presentation
1 / 9
Title:
Equilibrio qumico
Description:
En el equilibrio ?rG = 0 y por tanto la expresi n se reduce a: ... s , tomando como estado est ndar los componentes puros a la presi n de 1 bar ... – PowerPoint PPT presentation
Number of Views:33
Avg rating:3.0/5.0
Title: Equilibrio qumico
1
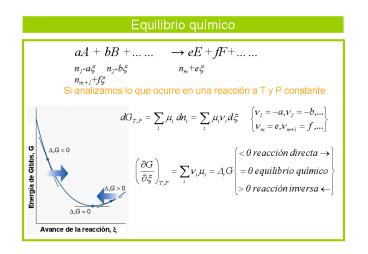
Equilibrio químico
aA bB ? eE fF
n1-ax n2-bx nmex
nm1fx
Si analizamos lo que ocurre en una reacción a T y
P constante
2
Equilibrio químico en gases ideales
En el equilibrio ?rG 0 y por tanto la
expresión se reduce a
Esta expresión permite definir una constante de
equilibrio adimensional que solo depende de la T
en gases ideales
3
Equilibrio químico en gases reales
Equilibrio químico en gases reales
En el equilibrio ?rG 0 y por tanto la
expresión se reduce a
Esta expresión permite definir una constante de
equilibrio adimensional que depende de la
temperatura y, en menor medida, de la presión
4
Otras formas de la constante de equilibrio
La constante de equilibrio de gases ideales se
puede expresar en función de las concentraciones,
utilizando la ecuación de estado
cº concentración molar estándar (1mol/L)
La constante de equilibrio de gases ideales se
puede expresar en función de las fracciones
molares, utilizando la ley de Dalton
5
Reacciones en fase líquida
Reactivos y productos totalmente miscibles entre
sí, tomando como estado estándar los componentes
puros a la presión de 1 bar
Esta expresión permite definir una constante de
equilibrio adimensional para una reacción en fase
líquida Si el comportamiento fuera ideal el
coeficiente de actividad toma el valor unidad y
se pueden escribir constantes de equilibrio
Todas las constantes de equilibrio son
adimensionales y se pueden relacionar entre sí
mediante la aproximación de disoluciones ideales
diluidas
6
Reacciones heterogéneas
aA(s) bB(dl) ? cC(dl) ?D(dl)
Aunque en la constante no aparece de forma
explícita la actividad del componente A, la
constante depende de este componente a través de
?rGº que depende del µAº
7
Variación de la constante de equilibrio con la
temperatura
Un incremento de la temperatura produce un
aumento de la constante en reacciones
endotérmicas y una disminución en reacciones
exotérmicas
8
Principio de Le Châtelier I
Cuando a un sistema en equilibrio se le somete a
una perturbación el sistema responde en la
dirección que minimiza los efectos de la
perturbación
9
Principio de Le Châtelier I
En el equilibrio ?rGG0, al ser un mínimo de la
curva de G frente a ?, por lo tanto, la derivada
segunda tiene que ser positiva